
| A、NH3 |
| B、N2 |
| C、NO2 |
| D、HNO3 |
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
| A、2Na+2H2O=2NaOH+H2↑ |
| B、2Na2O2+2H2O=4NaOH+O2↑ |
| C、3NO2+H2O=2HNO3+NO |
| D、2Cl2+2H2O=4HCl+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向碳酸氢钙溶液中加入足量氨水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| B、次氯酸钠溶液通入二氧化硫气体:2ClO-+SO2+H2O═2HClO+SO32- |
| C、向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-═2I2+2H2O |
| D、小苏打溶液中加入过量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
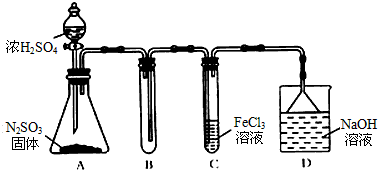
查看答案和解析>>
科目:高中化学 来源: 题型:
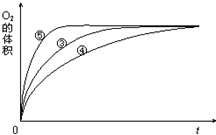 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 强热 |
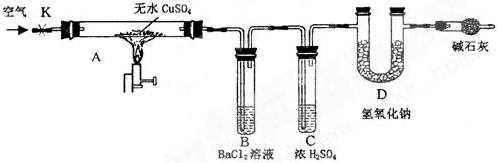
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液稳定,胶体和浊液都不稳定 |
| B、溶液中的分散质能通过滤纸但不能通过半透膜 |
| C、溶液和胶体的本质区别在于是否能产生丁达尔效应 |
| D、NaCl溶液和CaCO3悬浊液的本质区别是分散质粒子的大小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com