
| 转化的物质的量 |
| 起始物质的量 |
| 物质的量 |
| 体积 |
| 2×(3-x) |
| 2x-1+x+2×(3-x) |
| 2×(3-1.5) |
| 5 |
| 1.5 |
| 10 |
| 2×1.5-1+1.5+2×1.5 |
| 5+3 |
| 13 |
| 16 |


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、常温常压下,18gH2O所含原子数为NA |
| B、常温常压下,11.2L氧气含原子数为NA |
| C、2.3g金属钠变为钠离子失去0.1NA电子 |
| D、在同温同压时,相同体积的任何气体单质都含有相同数目的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
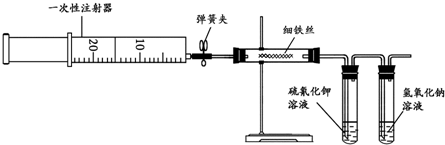
查看答案和解析>>
科目:高中化学 来源: 题型:
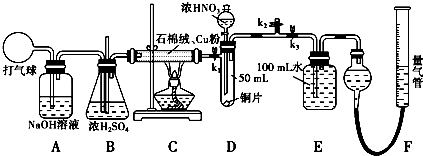
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、283kJ |
| B、110kJ |
| C、196.5kJ |
| D、56.6kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1+Q2+Q3 |
| B、0.5Q3-Q2+2Q1 |
| C、0.5Q3+Q2-2Q1 |
| D、0.5(Q1+Q2+Q3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性氧化物 七氧化二锰 Mn2O7 |
| B、酸性氧化物 干冰 CO |
| C、酸 硫酸 H2S |
| D、盐 纯碱 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、950mL,11.2g |
| B、500mL,117g |
| C、1000mL,117.0g |
| D、任意规格,111.2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com