
【题目】向27.2g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2 . 在所得溶液中加入1.0molL﹣1的NaOH溶液1.0L,此时溶液呈中性,金属铜离子已完全沉淀,沉淀质量为39.2g.下列有关说法不正确的是( )
A.Cu与Cu2O的物质的量之比为2:1
B.沉淀为氢氧化铜
C.产生的NO在标准状况下的体积为4.48 L
D.Cu、Cu2O与硝酸恰好完全反应
【答案】D
【解析】解:在所得溶液中加入NaOH溶液后,此时溶液呈中性,金属离子已完全沉淀,溶液中溶质为NaNO3 , n(NaNO3)=n(NaOH)=1.0mol/L×1.0L=1mol,沉淀为Cu(OH)2 , 质量为39.2g,物质的量为: ![]() =0.4mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol, 设Cu和Cu2O的物质的量分别为xmol、ymol,根据二者质量有 64x+144y=27.2,根据铜元素守恒有x+2y=0.4,联立方程解得:x=0.2、y=0.1,
=0.4mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol, 设Cu和Cu2O的物质的量分别为xmol、ymol,根据二者质量有 64x+144y=27.2,根据铜元素守恒有x+2y=0.4,联立方程解得:x=0.2、y=0.1,
A.由上述分析可知,n(Cu):n(Cu2O)=0.2mol:0.1mol=2:1,故A正确;
B.铜离子与氢氧化钠反应生成氢氧化铜沉淀,故B正确;
C.根据电子转移守恒可知:3n(NO)=2n(Cu)+2n(Cu2O),所以3n(NO)=2×0.2mol+2×0.1mol,解得:n(NO)=0.2mol,所以标准状况下NO的体积为:0.2mol×22.4L/mol=4.48L,故C正确;
D.生成氢氧化铜沉淀的物质的量为0.4mol,生成0.4mol氢氧化铜需要消耗NaOH的物质的量为0.8mol,而1.0L 1.0molL﹣1的NaOH溶液中含有NaOH的物质的量为1mol>0.8mol,说明有0.2molNaOH与硝酸发生反应,则Cu、Cu2O与硝酸的反应中硝酸过量,故D错误;
故选D.


科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. CaCO3(s) ![]() CaO(s)+CO2(g),平衡时将容器的体积缩小至一半,新平衡的CO2浓度与原平衡相同
CaO(s)+CO2(g),平衡时将容器的体积缩小至一半,新平衡的CO2浓度与原平衡相同
B. 升温Kw增加
C. 用热的纯碱溶液去污效果更佳
D. 恒温恒压的容器中有2NO2![]() N2O4,若通入Ar,气体的颜色先变浅后逐渐加深
N2O4,若通入Ar,气体的颜色先变浅后逐渐加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行以下可逆反应:M(g)+N(g)P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( ) 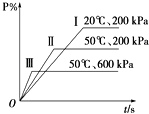
A.正反应放热,L是固体
B.正反应放热,L是气体
C.正反应吸热,L是气体
D.正反应放热,L是固体或气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各装置图的叙述中,不正确的是( )
A.
如图装置中a为阳极、b为阴极
B.
如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.
如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.
如图装置中的铁钉几乎不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置.
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置.将A、B、C、D 填入适当的空格中.
(1)分离植物油和水;
(2)除去粗盐中的泥沙;
(3)与海水晒盐原理相似的是;
(4)用四氯化碳碘水中提取碘;
(5)分离CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合物 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是( )
① 过滤② 蒸发③ 溶解④ 向容量瓶转移液体
A. ①和②B. ①和③C. ①和④D. ③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1.43gNa2CO3xH2O溶于水配成10mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0mL,并收集到112mL CO2(标准状况).试计算:
(1)CO2的物质的量
(2)Na2CO3xH2O的物质的量.
(3)x的值.
(4)所用稀盐酸的物质的浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置或操作进行相应实验,能达到实验目的是( ) 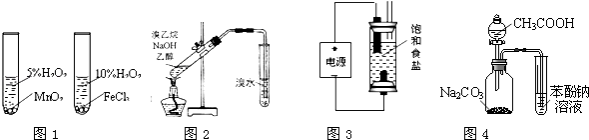
A.用图1装置验证比较不同催化剂对反应速率的影响
B.用图2所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
C.用图3装置制备少量含NaClO的消毒液
D.利用图4装置证明酸性:CH3COOH>H2CO3>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制1000mL1mol/LNaCl溶液,请完成以下步骤:①计算:需要称量克NaCl固体
②称量:用称量所需固体.
③溶解:将称量好的NaCl固体倒入烧杯中加水溶解,并恢复到室温.
④转移:将烧杯中的溶液用玻璃棒引流转移入中.
⑤洗涤:用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部转移入容量瓶 中如果没有将洗涤液转移人容量瓶,所配溶液的浓度将(填偏大或偏小)
⑥旋摇:轻轻旋摇容量瓶,使溶液混合均匀
⑦定容:向容量瓶中加水至距离刻度线1~2厘米处,改用滴
加水至溶液凹液面与刻度线相切.
⑧摇匀:上下颠倒摇匀,使溶液混合均匀
⑨装瓶贴签:将配制好的溶液转移到试剂瓶中,贴上标签.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com