
����Ŀ����1����֪2H��H2�ų�437.6 kJ������������˵����ȷ����_______
A. ����������ÿ����ԭ�Ӷ��ﵽ�ȶ��ṹ
B. �������ӵ�������������ԭ�ӵ�������
C. 1 mol H2 ���� 2 mol H Ҫ�ų�437.6 kJ����
D. ��ԭ�ӱ����������ȶ�
��2����֪ԭ��ص��ܷ�Ӧʽ��Cu + 2FeCl3 = CuCl2 + 2FeCl2����д���缫��Ӧ����ʽ��
����___________________________________
����___________________________________
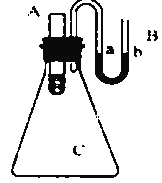
��3����ͼ��ʾ������ƿ����װ��ˮ��С�Թܣ���С�Թ��зֱ�����������ʣ����ռ���� ��Ũ���� ������粒����NaCl���壬������ʹa��Һ�����b��Һ�����_______________��������ţ�
��4����ѧ��������Ƴ�����̫���ܲ������⣬���ڶ������ѣ�TiO2����������ʹ��ˮ�ֽ�õ��������¼���2H2O![]() 2H2��+O2�����Ƶõ���������������ȼ�ϵ�أ��Իش��������⣺
2H2��+O2�����Ƶõ���������������ȼ�ϵ�أ��Իش��������⣺
�ٷֽ⺣ˮʱ��ʵ���˹���ת��Ϊ______�ܣ����ɵ�������������ȼ�ϵ��ʱ��ʵ���˻�ѧ��ת��Ϊ______�ܣ��ֽ⺣ˮ�ķ�Ӧ����______��Ӧ��������������������������
��ij������ȼ�ϵ�����ù�������������մ�������ʣ�A���Ϸ����ĵ缫��ӦΪ��2H2 + 2O24e=2H2O����A���ǵ�ص�______�������ӴӸü�______��������������������������B���ĵ缫��ӦʽΪ��_____________________��
���𰸡� A��B Cu �C 2e = Cu2+ 2Fe3+ + 2e = 2Fe2+ �� ��ѧ �� ���� ���� ���� O2 +4e =2O2
����������1����֪2H��H2�ų�437.6 kJ��������A. ������������һ�Թ��õ��Ӷԣ�ÿ����ԭ�Ӷ��ﵽHe���ȶ��ṹ��A��ȷ�� B. ����ԭ�ӱ�Ϊ���������ͷ����� �������������ӵ�������������ԭ�ӵ���������B��ȷ�� C. 1 mol H2 ���� 2 mol H Ҫ����437.6 kJ������C����ȷ�� D. ����Խ��Խ�ȶ������������ӱ���ԭ���ȶ���D����ȷ������������˵����ȷ����AB��
��2����ԭ��ص��ܷ�ӦʽCu + 2FeCl3 = CuCl2 + 2FeCl2����֪Cu����������������Ӧ��Fe3+�������Ϸ�����ԭ��Ӧ�������缫��ӦʽΪCu �C 2e = Cu2+�������缫��ӦʽΪ2Fe3+ + 2e = 2Fe2+ ��
��3����ͼ��֪������С�Թ��м����ռ��Ũ���ᣬ��������ˮ���ȣ���ƿ��������������ѹ�����ʹa��Һ�����b��Һ��������С�Թ��м������������������ˮ���ȣ���ƿ����ѹ��С����ʹa��Һ�����b��Һ�档������������ʹa��Һ�����b��Һ����Ǣ���
��4��������̫���ܲ�������ֽ⺣ˮʱ��ʵ���˹���ת��Ϊ��ѧ�ܣ����ɵ�������������ȼ�ϵ��ʱ����ѧ����ת��Ϊ���ܣ��ֽ⺣ˮ�ķ�Ӧ�������ȷ�Ӧ��
��ij������ȼ�ϵ�����ù�������������մ�������ʣ�A���Ϸ����ĵ缫��ӦΪ2H2 + 2O24e=2H2O���÷�ӦΪ������Ӧ����A���ǵ�صĸ��������ӴӸü�������B��Ϊ������������ԭ��Ӧ���缫��ӦʽΪO2 +4e =2O2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��DΪ������Ԫ�ع��ɵ��������ʣ�����������ת����ϵ��DΪǿ�����(����������ʿ���ʡ��)������˵������ȷ���ǣ� ��
![]()
A. ��AΪ�ǽ������ʣ�������Mg��Ӧ�IJ��������������Ӹ����ȿ���Ϊ2��3
B. ��AΪ�ǽ������ʣ��������Ԫ�������ڱ��е�λ�ÿ��ܴ��ڵ�2���ڢ�A��
C. ����AΪ���ʻ��ǻ����D���п�����ͬһ�����ʣ������ʵ�Ũ��Һ�ڳ����¶���ʹ�����������ۻ�
D. ��A�ǹ��ۻ����0.1molA�����к��еĵ���������ΪNA(NAΪ�����ӵ�������ֵ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͻ���һ����;�㷺�Ľ������ϡ����������У������ںϽ���ǣ� ��
A.�����B.��ͭC.Ӳ��D.ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ѧ���кܶ����ʿ���ʵ��ͼ������֮���ת�������з�Ӧ�����Ͳ��ַ�Ӧ�IJ�������ȥ��Һ��B��C�����ǵ�һ���ʵ���Һ��Ҳ�����Ǵ����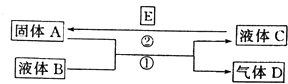
��1����A��һ���Ϻ�ɫ����������D��ʹƷ����Һ��ɫ������ʱ�ָֻ�ԭɫ��д����Ӧ�ٵĻ�ѧ����ʽ�� ��
������D����һ������H��Ϻ�����һ�ֵ���ɫ����W��д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2����A��һ�ֽ������ʣ�D���ܶ���С�����壬B�ܷ���ˮ����A�����ܡ���B��������
��3����A�ǽ������ʣ�D��һ����ɫ���壬����������Ϊ����ɫ��Һ��C����ɫ��д����Ӧ�ٵ����ӷ���ʽ�� �� д����Ӧ�ڵ�����һ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Fe��Cu��Fe2����Fe3����Cu2������ͬһ�����г�ַ�Ӧ����Fe��ʣ�࣬��������ֻ����
A. Cu��Fe3����Fe B. Fe2����Fe3����Fe
C. Cu��Cu2����Fe D. Cu��Fe2����Fe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƿ������Ʊ������ᣮ�Ծ�����ˮ��Ϊԭ���Ʊ��������ƾ��壨NaClO4H2O�����������£� 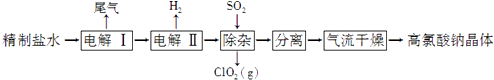
��1���ɴ��Σ���Ca2+��Mg2+�� ![]() ��Br�������ʣ��Ʊ�������ˮʱ���õ�NaOH��BaCl2��Na2CO3���Լ���Na2CO3������������ȥ��ˮ�е�Br�����Խ�ʡ�������еĵ��ܣ���ԭ���� ��
��Br�������ʣ��Ʊ�������ˮʱ���õ�NaOH��BaCl2��Na2CO3���Լ���Na2CO3������������ȥ��ˮ�е�Br�����Խ�ʡ�������еĵ��ܣ���ԭ���� ��
��2��������Ŀ�����Ʊ�NaClO3��Һ��������β����H2�⣬���������ѧʽ���������Ļ�ѧ����ʽΪ ��
��3�������ӡ���Ŀ���dz�ȥ������NaClO3���ʣ��÷�Ӧ�����ӷ���ʽΪ �� ���������ʱ���¶ȿ�����80��100���ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���о��к���ɫ����������Աȷ������ý��۲���ȷ���ǣ�������
|
|
|
�� | �� | �� |
A. �����еĺ���ɫ���壬�ƶϲ���������һ���ǻ������
B. ����ɫ���岻�ܱ�������ľ̿��Ũ��������˷�Ӧ
C. ����˵��Ũ������лӷ��ԣ����ɵĺ���ɫ����Ϊ��ԭ����
D. ������������м���CO2���ɴ�˵��ľ̿һ����Ũ���ᷢ���˷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧƷ�ķ�������ȷ����
A. �ռ�������ʴƷ B. ���Ȼ�̼������ȼҺ��
C. ������������ʪ��ȼ��Ʒ D. �����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20 mLŨ��Ϊ0.05 mol/L-1��Na2SO3��Һǡ����20 mLŨ��Ϊ0.02 mol/L��NaXO4��Һ��ȫ��Ӧ����Һ��XO4-����ԭΪ�ϵͼ�̬,��XԪ�صĻ��ϼ۱�Ϊ
A. +1 B. +2 C. +3 D. +4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com