
ЁОЬтФПЁПИпТШЫсФЦПЩгУгкжЦБИИпТШЫсЃЎвдОЋжЦбЮЫЎЕШЮЊдСЯжЦБИИпТШЫсФЦОЇЬхЃЈNaClO4H2OЃЉЕФСїГЬШчЯТЃК 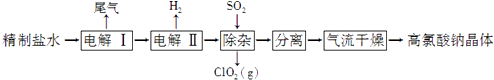
ЃЈ1ЃЉгЩДжбЮЃЈКЌCa2+ЁЂMg2+ЁЂ ![]() ЁЂBrЉЕШдгжЪЃЉжЦБИОЋжЦбЮЫЎЪБашгУЕНNaOHЁЂBaCl2ЁЂNa2CO3ЕШЪдМСЃЎNa2CO3ЕФзїгУЪЧЃЛГ§ШЅбЮЫЎжаЕФBrЉПЩвдНкЪЁЕчНтЙ§ГЬжаЕФЕчФмЃЌЦфдвђЪЧ ЃЎ
ЁЂBrЉЕШдгжЪЃЉжЦБИОЋжЦбЮЫЎЪБашгУЕНNaOHЁЂBaCl2ЁЂNa2CO3ЕШЪдМСЃЎNa2CO3ЕФзїгУЪЧЃЛГ§ШЅбЮЫЎжаЕФBrЉПЩвдНкЪЁЕчНтЙ§ГЬжаЕФЕчФмЃЌЦфдвђЪЧ ЃЎ
ЃЈ2ЃЉЁАЕчНтЂёЁБЕФФПЕФЪЧжЦБИNaClO3ШмвКЃЌВњЩњЕФЮВЦјГ§H2ЭтЃЌЛЙКЌгаЃЈЬюЛЏбЇЪНЃЉЃЎЁАЕчНтЂђЁБЕФЛЏбЇЗНГЬЪНЮЊ ЃЎ
ЃЈ3ЃЉЁАГ§дгЁБЕФФПЕФЪЧГ§ШЅЩйСПЕФNaClO3дгжЪЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊ ЃЎ ЁАЦјСїИЩдяЁБЪБЃЌЮТЖШПижЦдк80ЁЋ100ЁцЕФдвђЪЧ ЃЎ
ЁОД№АИЁП
ЃЈ1ЃЉГ§ШЅCa2+КЭв§ШыЕФBa2+ЃЛЕчНтЪБBrЉБЛбѕЛЏ
ЃЈ2ЃЉCl2ЃЛNaClO3+H2O ![]() NaClO4+H2Ёќ
NaClO4+H2Ёќ
ЃЈ3ЃЉ2ClO3Љ+SO2ЈT2ClO2+SO42ЉЃЛЮТЖШЬЋИпЃЌИпТШЫсФЦОЇЬхЪЇШЅНсОЇЫЎЛђЗжНтЃЛЮТЖШЬЋЕЭЃЌИЩдяВЛГфЗж
ЁОНтЮіЁПНтЃКЃЈ1ЃЉNa2CO3ЕФзїгУЪЧЬМЫсИљРызггыИЦРызгКЭçѐЫсИљРызгв§ШыЕФБЕРызгЗЂЩњИДЗжНтЗДгІЃЌЩњГЩФбШмЕФЬМЫсИЦКЭЬМЫсБЕЃЌЫљвдЬМЫсФЦЕФзїгУЮЊГ§ШЅИЦРызгКЭБЕРызгЃЌBrЉЕФЛЙдадЧПгкТШРызгЃЌЫљвдЕчНтЙ§ГЬжафхРызггХЯШБЛбѕЛЏЃЌЙЪД№АИЮЊЃКГ§ШЅCa2+КЭв§ШыЕФBa2+ЃЛЕчНтЪБBrЉБЛбѕЛЏЃЛЃЈ2ЃЉЕчНтЙ§ГЬжабєМЋТШРызгЗХЕчЃЌжївЊЩњГЩТШЫсИљРызгЃЌВПЗжВњЩњТШЦјЃЌЖјвѕМЋЧтРызгЗХЕчЃЌЩњГЩЧтЦјЃЌЫљвдЮВЦјгаЧтЦјКЭЩйСПЕФТШЦјЃЌЕчНтЂђТШЫсИљРызгдкбєМЋЗХЕчЩњГЩИпТШЫсИљЃЌЖјвѕМЋЪЧЫЎЕчРыВњЩњЕФЧтРызгЗХЕчЃЌЩњГЩЧтЦјЃЌЫљвдЕчНтЗДгІЗНГЬЪНЮЊЃКNaClO3+H2O ![]() NaClO4+H2ЁќЃЌЙЪД№АИЮЊЃКCl2ЃЛNaClO3+H2O
NaClO4+H2ЁќЃЌЙЪД№АИЮЊЃКCl2ЃЛNaClO3+H2O ![]() NaClO4+H2ЁќЃЛЃЈ3ЃЉгЩЭМЪОПЩжЊЭЈШыЖўбѕЛЏСђГ§ШЅЦфжаЕФТШЫсИљРызгЃЌЗДгІЕФРызгЗНГЬЪНЮЊЃК2ClO3Љ+SO2ЈT2ClO2+SO42Љ ЃЌ ЦјСїЮТЖШЬЋЕЭВЛЕУгкИЩдяЃЌЮТЖШЙ§ИпОЇЬхвЊЪЇЫЎЃЌЮТЖШЬЋИпТШЫсФЦПЩФмЗжНтЃЌЙЪД№АИЮЊЃК2ClO3Љ+SO2ЈT2ClO2+SO42ЉЃЛЮТЖШЬЋИпЃЌИпТШЫсФЦОЇЬхЪЇШЅНсОЇЫЎЛђЗжНтЃЛЮТЖШЬЋЕЭЃЌИЩдяВЛГфЗжЃЎ гЩдСЯТШЛЏФЦЕНИпТШЫсФЦОЇЬхЃЌТШЕФЛЏКЯМлЩ§ИпЃЌЖјећИіСїГЬжаЮДМгЧПбѕЛЏМСЃЌЫљвдЭЈЙ§ЕчНтЪЕЯжСЫТШЕФВЛЭЌМлЬЌЕФзЊЛЏЃЈЕчНтЙ§ГЬМДЮЊбѕЛЏЛЙдЗДгІЃЉЃЌНЋжЦЕУЕФбЮЫЎвЛДЮЕчНтВњЩњТШЫсФЦЃЌЕУЕНЕФТШЫсФЦШмвКНјаадйвЛДЮЕчНтЃЌЩњГЩИпТШЫсФЦЃЌШЛКѓЭЈШыЖўбѕЛЏСђГ§ШЅЦфжаЕФТШЫсФЦЃЌзюКѓНјааЗжРыЬсДПЕУЕНИпТШЫсФЦОЇЬхЃЌЃЈ1ЃЉNa2CO3ЕФзїгУЪЧЬМЫсИљРызггыИЦРызгКЭçѐЫсИљРызгв§ШыЕФБЕРызгЗЂЩњИДЗжНтЗДгІЃЌЩњГЩФбШмЕФЬМЫсИЦКЭЬМЫсБЕЃЛBrЉЕФЛЙдадЧПгкТШРызгЃЌЫљвдЕчНтЙ§ГЬжафхРызггХЯШБЛбѕЛЏЃЛЃЈ2ЃЉЕчНтЙ§ГЬжабєМЋТШРызгЗХЕчЃЌжївЊЩњГЩТШЫсИљРызгЃЌВПЗжВњЩњТШЦјЃЌЖјвѕМЋЧтРызгЗХЕчЃЌЩњГЩЧтЦјЃЌЫљвдЮВЦјгаЧтЦјКЭЩйСПЕФТШЦјЃЛЕчНтЂђТШЫсИљРызгдкбєМЋЗХЕчЩњГЩИпТШЫсИљЃЌЖјвѕМЋЪЧЫЎЕчРыВњЩњЕФЧтРызгЗХЕчЃЌЩњГЩЧтЦјЃЌЫљвдЕчНтЗДгІЗНГЬЪНЮЊЃКNaClO3+H2O
NaClO4+H2ЁќЃЛЃЈ3ЃЉгЩЭМЪОПЩжЊЭЈШыЖўбѕЛЏСђГ§ШЅЦфжаЕФТШЫсИљРызгЃЌЗДгІЕФРызгЗНГЬЪНЮЊЃК2ClO3Љ+SO2ЈT2ClO2+SO42Љ ЃЌ ЦјСїЮТЖШЬЋЕЭВЛЕУгкИЩдяЃЌЮТЖШЙ§ИпОЇЬхвЊЪЇЫЎЃЌЮТЖШЬЋИпТШЫсФЦПЩФмЗжНтЃЌЙЪД№АИЮЊЃК2ClO3Љ+SO2ЈT2ClO2+SO42ЉЃЛЮТЖШЬЋИпЃЌИпТШЫсФЦОЇЬхЪЇШЅНсОЇЫЎЛђЗжНтЃЛЮТЖШЬЋЕЭЃЌИЩдяВЛГфЗжЃЎ гЩдСЯТШЛЏФЦЕНИпТШЫсФЦОЇЬхЃЌТШЕФЛЏКЯМлЩ§ИпЃЌЖјећИіСїГЬжаЮДМгЧПбѕЛЏМСЃЌЫљвдЭЈЙ§ЕчНтЪЕЯжСЫТШЕФВЛЭЌМлЬЌЕФзЊЛЏЃЈЕчНтЙ§ГЬМДЮЊбѕЛЏЛЙдЗДгІЃЉЃЌНЋжЦЕУЕФбЮЫЎвЛДЮЕчНтВњЩњТШЫсФЦЃЌЕУЕНЕФТШЫсФЦШмвКНјаадйвЛДЮЕчНтЃЌЩњГЩИпТШЫсФЦЃЌШЛКѓЭЈШыЖўбѕЛЏСђГ§ШЅЦфжаЕФТШЫсФЦЃЌзюКѓНјааЗжРыЬсДПЕУЕНИпТШЫсФЦОЇЬхЃЌЃЈ1ЃЉNa2CO3ЕФзїгУЪЧЬМЫсИљРызггыИЦРызгКЭçѐЫсИљРызгв§ШыЕФБЕРызгЗЂЩњИДЗжНтЗДгІЃЌЩњГЩФбШмЕФЬМЫсИЦКЭЬМЫсБЕЃЛBrЉЕФЛЙдадЧПгкТШРызгЃЌЫљвдЕчНтЙ§ГЬжафхРызггХЯШБЛбѕЛЏЃЛЃЈ2ЃЉЕчНтЙ§ГЬжабєМЋТШРызгЗХЕчЃЌжївЊЩњГЩТШЫсИљРызгЃЌВПЗжВњЩњТШЦјЃЌЖјвѕМЋЧтРызгЗХЕчЃЌЩњГЩЧтЦјЃЌЫљвдЮВЦјгаЧтЦјКЭЩйСПЕФТШЦјЃЛЕчНтЂђТШЫсИљРызгдкбєМЋЗХЕчЩњГЩИпТШЫсИљЃЌЖјвѕМЋЪЧЫЎЕчРыВњЩњЕФЧтРызгЗХЕчЃЌЩњГЩЧтЦјЃЌЫљвдЕчНтЗДгІЗНГЬЪНЮЊЃКNaClO3+H2O ![]() NaClO4+H2ЁќЃЛЃЈ3ЃЉгЩЭМЪОПЩжЊЭЈШыЖўбѕЛЏСђГ§ШЅЦфжаЕФТШЫсИљРызгЃЌЗДгІЕФРызгЗНГЬЪНЮЊЃК2ClO3Љ+SO2ЈT2ClO2+SO42Љ ЃЌ ЦјСїЮТЖШЬЋЕЭВЛЕУгкИЩдяЃЌЮТЖШЙ§ИпОЇЬхвЊЪЇЫЎвдНсКЯПМТЧИпТШЫсФЦБОЩэЕФЮШЖЈадЃЎ
NaClO4+H2ЁќЃЛЃЈ3ЃЉгЩЭМЪОПЩжЊЭЈШыЖўбѕЛЏСђГ§ШЅЦфжаЕФТШЫсИљРызгЃЌЗДгІЕФРызгЗНГЬЪНЮЊЃК2ClO3Љ+SO2ЈT2ClO2+SO42Љ ЃЌ ЦјСїЮТЖШЬЋЕЭВЛЕУгкИЩдяЃЌЮТЖШЙ§ИпОЇЬхвЊЪЇЫЎвдНсКЯПМТЧИпТШЫсФЦБОЩэЕФЮШЖЈадЃЎ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉZn-MnO2ИЩЕчГигІгУЙуЗКЃЌЦфЕчНтжЪШмвКЪЧZnCl2-NH4ClЛьКЯШмвКЁЃ
ЂйИУЕчГиЕФИКМЋВФСЯЪЧ______________ЁЃЕчГиЙЄзїЪБЃЌЕчзгСїЯђ______________(ЬюЁАе§МЋЁБЛђЁАИКМЋЁБ)ЁЃ
ЂкШєZnCl2-NH4ClЛьКЯШмвКжаКЌгадгжЪCu2+,ЛсМгЫйФГЕчМЋЕФИЏЪДЃЌЦфжївЊдвђЪЧ______________ЁЃгћГ§ШЅCu2+ЃЌзюКУбЁгУЯТСаЪдМСжаЕФ______________(ЬюзжФИађКХ)ЁЃ
aЃЎNaOH bЃЎZn cЃЎFe dЃЎNH3ЁЄH2O
ЃЈ2ЃЉИјФуЬсЙЉДПаПЦЌЁЂДПЭЦЌКЭ500mL0.2molЁЄL-1ЕФH2SO4ШмвКЁЂЕМЯпЁЂ1000mLСПЭВЁЃЪдгУгвЭМзАжУРДВтЖЈаПКЭЯЁСђЫсЗДгІЪБдкФГЖЮЪБМфФкЭЈЙ§ЕМЯпЕФЕчзгЕФЮяжЪЕФСПЁЃ
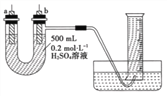
ЂйзАжУЦјУмадСМКУЃЌЧв1000mLСПЭВжавбГфТњСЫЫЎЃЌдђПЊЪМЪЕбщЪБЃЌЪзЯШвЊ______________ЁЃ
ЂкaЕчМЋВФСЯЮЊ______________ЃЌЦфЕчМЋЗДгІЪНЮЊ______________ЃЛbЕчМЋВФСЯЮЊ______________ЃЌЦфЕчМЋЗДгІЪНЮЊ______________ЁЃ
ЂлЕБСПЭВжаЪеМЏ672mLЦјЬхЪБ(вбелЫуГЩБъзМзДПіЯТ)ЃЌЭЈЙ§ЕМЯпЕФЕчзгЕФЮяжЪЕФСПЮЊ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП1.92g CuЦЌгывЛЖЈСПЕФХЈHNO3зїгУЃЌЕБЪеМЏЕНNO2КЭNOЦјЬхЙВ1.12LЪБЃЈБъзМзДПіЃЉЃЌН№ЪєЭЧЁКУШЋВПзїгУЃЎдђЃК
ЃЈ1ЃЉЗДгІжаЯћКФHNO3molЃЌзЊвЦЕчзгmolЃЎ
ЃЈ2ЃЉгУХХЫЎЗЈЪеМЏЩњГЩЕФЦјЬхЃЌзюКѓЦјЬхЕФЬхЛ§ЮЊLЃЈБъзМзДПіЃЉЃЎ
ЃЈ3ЃЉЯђЪеМЏЕНЕФЦјЬхжаЭЈШыmL O2ЃЈБъзМзДПіЃЉВХФмЪЙЫЎИеКУГфТњећИіМЏЦјШнЦїЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЫљЪОзАжУЃЌЕчСїМЦжИеыЗЂЩњЦЋзЊЃЌЭЌЪБAМЋж№НЅБфДжЃЌBМЋж№НЅБфЯИЃЌCЮЊЕчНтжЪШмвКЃЌдђAЁЂBЁЂCПЩФмЪЧЯТСаИїзщжаЕФ
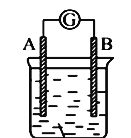
A. AЪЧAgЃЌBЪЧFeЃЌCЮЊЯЁAgNO3ШмвК
B. AЪЧCuЃЌBЪЧZnЃЌCЮЊЯЁH2SO4
C. AЪЧFeЃЌBЪЧAgЃЌCЮЊЯЁAgNO3ШмвК
D. AЪЧZnЃЌBЪЧCuЃЌCЮЊЯЁH2SO4
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉвбжЊ2HЁњH2ЗХГі437.6 kJЕФШШСПЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ_______
A. ЧтЦјЗжзгФкУПИіЧтдзгЖМДяЕНЮШЖЈНсЙЙ
B. ЧтЦјЗжзгЕФФмСПБШСНИіЧтдзгЕФФмСПЕЭ
C. 1 mol H2 РыНтГЩ 2 mol H вЊЗХГі437.6 kJШШСП
D. ЧтдзгБШЧтЦјЗжзгЮШЖЈ
ЃЈ2ЃЉвбжЊдЕчГиЕФзмЗДгІЪНЃКCu + 2FeCl3 = CuCl2 + 2FeCl2ЃЌЧыаДГіЕчМЋЗДгІЗНГЬЪНЃК
ИКМЋ___________________________________
е§МЋ___________________________________
ЃЈ3ЃЉШчЭМЫљЪОЃЌдкзЖаЮЦПЗХжУзАгаЫЎЕФаЁЪдЙмЃЌЭљаЁЪдЙмжаЗжБ№МгШыЯТСаЮяжЪЃКЂйЩеМюЙЬЬх ЂкХЈСђЫс ЂлЯѕЫсяЇЙЬЬхЂмNaClЙЬЬхЃЌЦфжаФмЪЙaЖЫвКУцИпгкbЖЫвКУцЕФЪЧ_______________ЁЃЃЈЬюађКХЃЉ
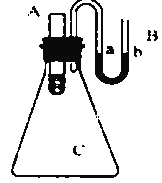
ЃЈ4ЃЉПЦбЇМвзюНќбажЦГіРћгУЬЋбєФмВњЩњМЄЙтЃЌВЂдкЖўбѕЛЏюбЃЈTiO2ЃЉБэУцзїгУЪЙКЃЫЎЗжНтЕУЕНЧтЦјЕФаТММЪѕ2H2O![]() 2H2Ёќ+O2ЁќЁЃжЦЕУЕФЧтЦјПЩгУгкжЦзїШМСЯЕчГиЃЎЪдЛиД№ЯТСаЮЪЬтЃК
2H2Ёќ+O2ЁќЁЃжЦЕУЕФЧтЦјПЩгУгкжЦзїШМСЯЕчГиЃЎЪдЛиД№ЯТСаЮЪЬтЃК
ЂйЗжНтКЃЫЎЪБЃЌЪЕЯжСЫЙтФмзЊЛЏЮЊ______ФмЃЛЩњГЩЕФЧтЦјгУгкжЦзїШМСЯЕчГиЪБЃЌЪЕЯжСЫЛЏбЇФмзЊЛЏЮЊ______ФмЃЛЗжНтКЃЫЎЕФЗДгІЪєгк______ЗДгІЃЈЬюЁАЗХШШЁБЛђЁАЮќШШЁБЃЉЁЃ
ЂкФГжжЧтбѕШМСЯЕчГиЪЧгУЙЬЬхН№ЪєбѕЛЏЮяЬеДЩзїЕчНтжЪЃЌAМЋЩЯЗЂЩњЕФЕчМЋЗДгІЮЊЃК2H2 + 2O24e=2H2OЃЌдђAМЋЪЧЕчГиЕФ______МЋЃЌЕчзгДгИУМЋ______ЃЈЬюЁАСїШыЁБЛђЁАСїГіЁБЃЉЃЌBМЋЕФЕчМЋЗДгІЪНЮЊЃК_____________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгаЯТСаЖЬжмЦкдЊЫиЕФЪ§ОнЃЈвбжЊBeЕФдзгАыОЖЮЊ0.089 nmЃЉЃК
Ђй | Ђк | Ђл | Ђм | Ђн | Ђо | Ђп | Ђр | |
дзгАыОЖ ЃЈnmЃЉ | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
зюИпе§ЛЏКЯМл | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
зюЕЭИКЛЏКЯМл | 2 | 3 | 1 | 3 |
ЃЈ1ЃЉЂрКХдЊЫиЕФдкжмЦкБэжаЕФЮЛжУЪЧ________________ЃЛЩЯЪідЊЫиДІгкЭЌвЛжїзхЕФга_________________________ЁЃЃЈгУдЊЫиЗћКХБэЪОЃЁЃЉ
ЃЈ2ЃЉЩЯБэжаФГСНжждЊЫиаЮГЩЕФЙВМлЛЏКЯЮяжаЃЌУПИідзгЖМТњзузюЭтВуЮЊ8ЕчзгЕФЮШЖЈНсЙЙЃЌаДГіЦфЕчзгЪНЃК__________________________(ШЮаДвЛжж
ЃЈ3ЃЉдЊЫиЂйКЭЂоФмаЮГЩСНжжЛЏКЯЮяЃЌаДГіЦфжаНЯЮШЖЈЕФЛЏКЯЮягыЫЎЗДгІЕФРызгЗНГЬЪН_____________________________________________________ЁЃ
ЃЈ4ЃЉКЌяЎВФСЯдкЩчЛсжаЙуЗКгІгУЃЌШчИїжжДЂЧтВФСЯЃЈLi2NHЕШЃЉЁЂБуаЏЪНЕчдДВФСЯЃЈLiCoO2ЕШЃЉЁЃИљОнЯТСавЊЧѓЛиД№ЮЪЬтЃК
Ђй![]() КЭ
КЭ![]() зїКЫЗДгІЖбзюМбШШдиЬхЃЌ
зїКЫЗДгІЖбзюМбШШдиЬхЃЌ![]() КЭ
КЭ![]() гУзїИпЮТЖбМѕЫйМСЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ________
гУзїИпЮТЖбМѕЫйМСЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ________
A. ![]() КЭ
КЭ![]() ЛЅЮЊЭЌЮЛЫи B.
ЛЅЮЊЭЌЮЛЫи B. ![]() КЭ
КЭ![]() ЪєгкЭЌжжКЫЫи
ЪєгкЭЌжжКЫЫи
C. ![]() КЭ
КЭ![]() ЕФЛЏбЇаджЪВЛЭЌ D.
ЕФЛЏбЇаджЪВЛЭЌ D. ![]() КЭ
КЭ![]() ЪЧЭЌжжЮяжЪ
ЪЧЭЌжжЮяжЪ
ЂкЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ_________
A. МюадЃКBe(OH)2 < LiOH < NaOH < KOH
B. АыОЖЃКK > Na > Li > Li+
C. бѕЛЏадЃКLi+ < Na+ < K+ < Rb+ < Cs+
D. Н№ЪєадЃКCs > Rb > K > Na > Li > Be
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкВЛЭЌЮТЖШЯТЃЌЯђ2LУмБеШнЦїжаМгШы1mol NOКЭ1molЛюадЬПЃЌЗЂЩњЗДгІЃК
2NO(g)+C(s) ![]() N2(g)+CO2(g) ІЄH=-213.5kJ/molЃЌДяЕНЦНКтЪБЕФЪ§ОнШчЯТЃК
N2(g)+CO2(g) ІЄH=-213.5kJ/molЃЌДяЕНЦНКтЪБЕФЪ§ОнШчЯТЃК
ЮТЖШ/Ёц | n(ЛюадЬП)/mol | n(CO2)/mol |
T1 | X | |
T2 | 0.25 |
ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
A. T2ЁцЪБЃЌШєИУЗДгІОЙ§10minДяЕНЦНКтЃЌЗДгІЫйТЪv(NO)=0.025mol/(LЁЄmin)
B. T1ЁцЪБЃЌШєИУЗДгІЕФЦНКтГЃЪ§K=9/16ЃЌдђДяЦНКтЪБNOЕФзЊЛЏТЪЮЊ60%
C. T2ЁцЪБЃЌШєЗДгІДяЦНКтКѓдйЫѕаЁШнЦїЕФЬхЛ§ЃЌc(N2):c(NO)ВЛБф
D. T1ЁцЪБЃЌШєПЊЪМЪБЗДгІЮяЕФгУСПОљМѕЩйвЛАыЃЌЦНКтКѓNOЕФзЊЛЏТЪМѕаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкФГ100 mLЛьКЯвКжаЃЌHNO3КЭH2SO4ЕФЮяжЪЕФСПХЈЖШЗжБ№ЪЧ0.4 molЁЄL1ЁЂ0.2 molЁЄL1ЁЃЯђИУЛьКЯвКжаМгШы1.92 gЭЗлЃЌМгШШЃЌД§ГфЗжЗДгІКѓ(МйЩшЗДгІЧАКѓШмвКЬхЛ§ВЛБф)ЃЌЫљЕУШмвКжаЕФCu2+ЕФЮяжЪЕФСПХЈЖШ(molЁЄL1)ЪЧЃЈ ЃЉ
A. 0.15 B. 0.225 C. 0.3 D. 0.45
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщжаЕФСНжжЮяжЪзїгУЪБЃЌЗДгІЬѕМўЛђЗДгІЮяЕФгУСПИФБфЪБЃЌЖдЩњГЩЮяУЛгагАЯьЕФЪЧ
A. NaгыO2 B. Na2O2гыCO2 C. CгыO2 D. NaOHгыCO2
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com