
����Ŀ��25��ʱ��Ksp(AgCl)��1.56��10��10��Ksp(Ag2CrO4)��9.0��10��12������˵����ȷ����(����)
A. ��Ag2CrO4����Һ�м���NaClŨ��Һ��Ag2CrO4������ת��ΪAgCl
B. ��AgCl������Һ�м���NaCl���壬��AgCl��������Һ��c(Cl��)��c(Ag��)
C. AgCl��Ag2CrO4���������Һ�У�![]() ��
��![]()
D. ��ͬŨ�ȵ�Na2CrO4��NaCl�����Һ�еμ�AgNO3��Һ��AgCl������
���𰸡�D
��������Ag2CrO4�ܽ�ȴ���AgCl�����������������������ת�������ƣ���![]() Ag2CrO4��ת��ΪAgCl����A������AgCl������Һ�м���NaCl���壬����AgCl����������c��Ag+����c��Cl-��=1.56��10-10����c��Cl-����c��Ag+������B�������߹������Һ�У����ڣ�Ksp��AgCl��=c��Ag+����c��Cl-��=1.56��10-10��Ksp��Ag2CrO4��=c2��Ag+����c��CrO42-��=9.0��10-12����
Ag2CrO4��ת��ΪAgCl����A������AgCl������Һ�м���NaCl���壬����AgCl����������c��Ag+����c��Cl-��=1.56��10-10����c��Cl-����c��Ag+������B�������߹������Һ�У����ڣ�Ksp��AgCl��=c��Ag+����c��Cl-��=1.56��10-10��Ksp��Ag2CrO4��=c2��Ag+����c��CrO42-��=9.0��10-12����![]() =
=![]() ����C������������ʱ��AgCl��Һ��c��Ag+��=
����C������������ʱ��AgCl��Һ��c��Ag+��=![]() ��Ag2CrO4��Һ��c��Ag+��=
��Ag2CrO4��Һ��c��Ag+��=![]() ��ͬŨ�ȵ�Na2CrO4��NaCl���ݴ˵ó����ߴ���ǰ�ߣ�c��Ag+��ԽС����Խ�����ɳ����������������Ӳ����������Ⱥ�˳��ΪCl-��CrO42-����D��ȷ��
��ͬŨ�ȵ�Na2CrO4��NaCl���ݴ˵ó����ߴ���ǰ�ߣ�c��Ag+��ԽС����Խ�����ɳ����������������Ӳ����������Ⱥ�˳��ΪCl-��CrO42-����D��ȷ��


 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ��ʮ����Ϥ�����ʣ������෴Ӧ�мȿ���Ϊ��Ӧ�Ҳ����Ϊ�����
��1����ⱥ��ʳ��ˮ����ȡ��������Ӧ�Ļ�ѧ����ʽ____��
��2����������ԭ����ͭ�ķ�Ӧ�У��������ת�Ƶķ�����Ŀ��____
H2+CuO![]() Cu+H2O
Cu+H2O
��3����ͭпԭ����У���ͼ����ͭ������������������____�����������___��

��4��������Ϊȼ�ϣ���1g����ȼ������Һ̬ˮ�ų�142.8kJ��������ʾ�÷�Ӧ���Ȼ�ѧ����ʽ_____��
��5��ʵ������п��ϡ���ᷴӦ��ȡ������ijѧУʵ��ԱΪ�����������ٶȣ��ڴ���Һ�м�����������ͭ��Һ������Ϊ������Ϊʲô��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ھ���˵������ȷ����ǡ�����

�ٷ��Ӿ����ж����ڹ��ۼ���
���ھ�����ֻҪ�������Ӿ�һ���������ӡ�
�۽��ʯ��SiC��NaF��NaCl��H2O��H2S������۵����ν��͡�
�����Ӿ�����ֻ�����Ӽ�û�й��ۼ������Ӿ����п϶�û�����Ӽ���
��CaTiO3������(�����ṹ����ͼ��ʾ)ÿ��Ti4����12��O2�����ڡ�
��SiO2������ÿ����ԭ����������ԭ���Թ��ۼ����ϡ�
�߾����з��Ӽ�������Խ����Խ�ȶ���
���Ȼ����ۻ�ʱ���Ӽ����ƻ�
A���٢ڢۢޡ������� ����B���٢ڢ�
C���ۢݢ� D���ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��Cʱ�����������Ƶ���Ũ��Ϊ2.0��10-3mol L-1���������Һ��pH (������� �仯)����Һ��c(HF)��c(F- )��pH�ı仯��ϵ����ͼ��ʾ������˵������ȷ����

A. abd���ߴ���c(F-)��pH�ı仯
B. 25 ��Cʱ��HF����ƽ�ⳣ������ֵKa=10-3.6
C. ��b�㵽c�㷢�������ӷ�Ӧ����ʽ�ǣ�HF + OH- = H2O+ F-
D. ͼ��a����Һ����Ũ�ȴ�С��:c(HF)>c(H+)>c(F-)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ý�̿��ȡˮú���������ѹ㷺���ڹ�ҵ�����С�
I���Խ�̿�Ƹ�ˮú��
��֪����C(s)+H2O (g)=CO(g)+H2(g) ![]() H= +130.0KJ/mol
H= +130.0KJ/mol
��CO2 (g)+H2(g)=CO(g)+H2O(g) ![]() H= +40.0KJ/mol
H= +40.0KJ/mol
(1) �ڹ�ҵ�ϣ���Ӧ����ú���ۺ����õ�һ��;������������______�� ��̿��ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽΪ_____ ��
I I ��̿������������
500��Cʱ�����ܱ������н���̿�����е�CO2ת��Ϊ�����ѣ�����ط�ӦΪ��
����Ӧ��2CO2 (g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
����Ӧ��CO2 (g)+3H2(g)![]() CH3OH(g)+2H2O(g)
CH3OH(g)+2H2O(g)
(2)��ò�ͬʱ��β������ʵ�Ũ�����±���

��1020 m in�ڣ�CH3OCH3��ƽ����Ӧ����V(CH3OCH3)=__________�� �� �������ض������£���֪����Ӧ�����ʷ���Ϊv=kca(CO2)��cb(H2)/cm(CH3OCH3) (k Ϊ���ʳ���,a�� b��m������0 ) , ���д�ʩһ�����������Ӧ�ķ�Ӧ���ʵ���______ (����ĸ���)��
A . �ʵ��¶� B .�����������
C . ��ѹ��Сc(CO2)/c(H2) D . ����������c(CO2)
�����CH3OCH3���ʵĹؼ���������ѡ�ú��ʵĴ�������ԭ����______ �� ����ʼʱCO2 ��H2��Ũ�ȱ�Ϊ1:3,�����������ݼ��㣬��������Ӧ��ƽ�ⳣ���ļ������ʽK= ______

(3)�Ը÷�Ӧʵ���о��ó�������ͬ�¶��£�CO2��ת���ʵ����������������ɱȵı仯��ϵ��ͼ��ʾ�����¶Ȳ��䣬������n(Mn)/n(Cu)Լ��______ ʱ�������ڶ��ײ[�ĺϳɣ���ʱ��������ӦͶ�ϱ�n(H2)/n(CO2),ƽ�ⳣ��K��____ (�� ��������������С���� ��������).
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����Ϊ̽������Ũ����(����)�ķ�Ӧ������֤SO2�����ʣ������ͼ��ʾװ�ý���ʵ�飬����˵������ȷ����( )
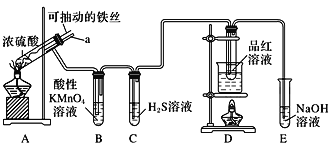
A��װ��B������KMnO4��Һ����ɫ�������˶�������Ļ�ԭ�� |
B��ʵ����������װ��A����Һ�еμ�KSCN��Һ�Լ������ɵ�Fe3+ |
C��װ��D��Ʒ����Һ��ɫ������֤SO2��Ư���� |
D��ʵ��ʱ������a����Ũ�����У��ɷ�ֹװ��B�е���Һ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������




�� �� �� ��
A. ͼ�ױ�ʾ������ϡ��pH��Ϊ11��MOH��Һ��NOH��ҺʱpH�ı仯����ͼ��֪��Һ�ļ��ԣ�MOH��NOH
B. ͼ�ұ�ʾ������0.100 0 mol��L��1������Һ�ζ�20.00 mL0.100 0 mol��L��1 NaOH��Һ�ĵζ�����
C. ͼ����ʾ��ӦCH4(g)��H2O (g)![]() CO(g)��3H 2(g)�������仯��ʹ�ô����ɸı�Eb��Ea��ֵ
CO(g)��3H 2(g)�������仯��ʹ�ô����ɸı�Eb��Ea��ֵ
D. ͼ����ʾ��Ӧ2CO(g)��2NO(g)![]() N2(g)��2CO2(g)����������������ʱ���ı���ʼCO�����ʵ�����ƽ��ʱN2����������仯����ͼ��֪NO��ת����c��b��a
N2(g)��2CO2(g)����������������ʱ���ı���ʼCO�����ʵ�����ƽ��ʱN2����������仯����ͼ��֪NO��ת����c��b��a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȣ�Li/SOCl2�������ʵ��Ӧ�õ��ϵ���б�������ߵ�һ�ֵ�أ�����ͼ��ͼ��ʾ��һ�ַ�ˮ��LiAlCl4��SOCl2��ҺΪ���Һ���������ȼ��ǵ���ʣ����������������ʣ�����̼�缫���ĵ缫��ӦʽΪ2SOCl2+4e-=4Cl-+S+SO2�����õ�ع���ʱ������˵��������ǣ�������

A. ﮵缫�������ĵ缫��Ӧ��Li-e-=Li+
B. �ŵ�ʱ�������ܷ�Ӧ��4Li+2SOCl2=4LiCl+SO2��+S
C. ﮵缫�ϵĵ��Ʊ�̼�缫�ϵĵ�
D. ������ˮ��Һ����SOCl2��Һ������ܷ�Ӧ��Ч�ʾ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��TiC14���Ʊ��Ѽ��仯�������Ҫ�м��壬ijС��ͬѧ��������װ����ʵ�����Ʊ�TiCl4�����ʵ������(�г�װ����ȥ)��

��֪����PdC12��Һ����COʱ�����ɽ������ʺ������������廯���
��

��ش��������⣺
(1)�������������ҵķ�������װ�ú���������˳��Ϊa��____��____��f��g��___��____��_____��_____��_____(�������ӿ���ĸ)��
(2)����������ʵ��װ�ý���ʵ�飬ʵ�鲽�����£����װ�������Ժ�װ��ҩƷ��_____________(����ȷ��˳���������в��������)��
�ٹرշ�Һ©������ �ڴ�Һ©������
��ֹͣ���ȣ������ȴ �ܼ���װ��D���մɹ�
(3)װ��D�г�����TiCl4�⣬ͬʱ����һ����̬������������÷�Ӧ�Ļ�ѧ����ʽΪ________��
(4)���ʵ��֤��װ��E���ռ�����Һ���к���TiCl4��__________________________��
(5)װ��F�з�����Ӧ�Ļ�ѧ����ʽΪ_____________������������Ҳ�ɴ���װ��F��������______(д��һ�ּ���)��
(6)�Ƶõ�TiC14��Ʒ�г���������CC14���Ӳ�Ʒ�з����TiC14�IJ�������Ϊ_________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com