
已知 pOH=-lg[OH-],下列溶液一定呈中性的是
A.由等体积、等物质的量浓度的一元酸跟NaOH溶液混合后所形成的溶液
B.[H+]=1.0×10-7mol·L-1的溶液
C.pH=14-pOH的溶液
D.pH=pOH的溶液
D
【解析】
试题解析:一元酸的强弱不确定,等体积等浓度的一元强酸、强碱混合后溶液才呈中性,故A错误;溶液的温度不知,同一溶液温度越高氢离子浓度越大,如100℃时纯水中,c(H+)>1.0×10-7 mol?L-1,所以c(H+)=1.0×10-7 mol?L-1的溶液不一定显中性,故B错误;已知pOH=-lgc(OH-),PH=-lgc(H+),如果在常温下,则pOH+PH=-lgc(OH-)-lgc(H+)=-lg[c(OH-)×c(H+)]=14,pH=14-pOH,但不能判断溶液中 c(H+)与c(OH-)的 相对大小,故C错误;pH=pOH即-lgc(OH-)=-lgc(H+),所以 c(H+)=c(OH-),即溶液显中性,故D正确。
考点:溶液的酸碱性


科目:高中化学 来源:2014-2015学年山东省潍坊三县市高二上学期联考化学试卷(解析版) 题型:填空题
(15分)甲醇(CH3OH)是一种可再生能,具有开发和应用的广阔前景,工业上一般可采用如下反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)t℃时,往1L密闭容器中充入1mol CO和2molH2。10min后,反应达到平衡,并测得CH3OH(g)的浓度为0.8 mol·L-1。
①该时间内反应速率v(H2) =____。t℃时,该反应的化学平衡常数K= (mol·L-1)-2
②下列各项中,能说明该反应已达到平衡的是_____________(填序号)
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,测得v正(CO) =v逆(CH3OH)
c.恒温、恒容条件下,容器内的气体密度不发生变化
d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH(g)
(2)下图是该反应在T1 、T2温度下CO的转化率随时间变化的曲线。
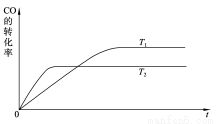
①该反应的焓变ΔH____0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1____________K2(填“>”、“<”或“=”)。
③若保持容器容积不变,下列措施可增加甲醇产率的是______________。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(g) ΔH=____________kJ·mol-1。
(4)我国在甲醇燃料电池技术方面已获得重大突破。甲醇燃料电池的工作原理如图所示。
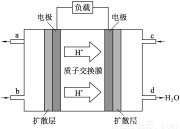
①该电池工作时,b口通入的物质为______。
②该电池正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市普高高二上学期期中理科化学试卷(解析版) 题型:填空题
铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是 ________(用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是 ________nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________________________________________。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是_________________________,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)= mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是 。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
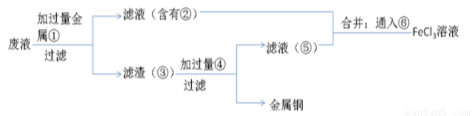
A请写出上述实验中加入或生成的有关物质的化学式:
①_____________②____________③______________④________________
B请写出通入⑥的化学方程式__________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市普高高二上学期期中理科化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.直径介于1~10 nm之间的粒子称为胶体
B.Fe(OH)3胶体是纯净物
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子不可以透过滤纸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省乐陵市高二上学期期中考试化学试卷(解析版) 题型:填空题
(16分)(I)某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4 ==H2↑+CuSO4,试回答:
==H2↑+CuSO4,试回答:

(1)该装置的名称是 (填“电解池”或“原电池”)。
(2)A、B中至少有一种是金属 (填名称),接电源的 (填“正极”或“负极”)。
(3)写出该装置中发生还原反应的电极反应方程式为 。
(4)若C溶液为100ml饱和食盐水,A 和B电极均为碳棒,该学生利用图示装置进行电解,写出该电解过程中的总反应的离子方程式 ,当放出标况下112ml氢气时,该溶液的PH= (室温下)。
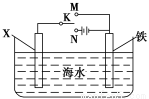
(II)利用下图装置,可以模拟铁的电化学防护。若X为铜,为减缓铁的腐蚀,开关K应置于________处。若X为锌棒,开关K置于M处,该电化学防护法称为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省乐陵市高二上学期期中考试化学试卷(解析版) 题型:选择题
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是
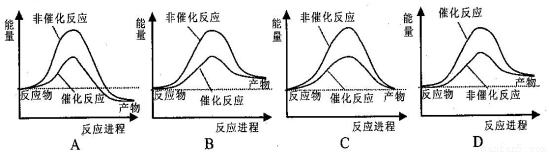
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省乐陵市高二上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D. 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率减慢
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东桓台第二中学高二上学期(10月)检测化学试卷(解析版) 题型:选择题
下列推断正确的是
A.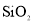 是酸性氧化物,能与NaOH溶液反应
是酸性氧化物,能与NaOH溶液反应
B.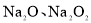 组成元素相同,与
组成元素相同,与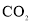 反应产物也相同
反应产物也相同
C.CO、NO、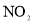 都是大气污染气体,在空气中都能稳定存在
都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东安丘市期中考试高二化学模拟(B)卷(解析版) 题型:选择题
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)  zC(g),平衡时测得A的浓度为0.50 mol·L-1,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol·L-1。下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为0.50 mol·L-1,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol·L-1。下列有关判断正确的是( )
A.x+y<z B.平衡向正反应方向移动 C.B的转化率增大 D.C的体积分数下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com