
【题目】![]() 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:

已知:①![]() 是一种不溶于水易溶于强酸的沉淀
是一种不溶于水易溶于强酸的沉淀
②已知![]() ,
,![]() 的
的![]()
(1)Ni的原子序数为28,则它在周期表中的位置为______,写出H2O2的结构式______。
(2)步骤①,用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有______(任写一点)。
(3)步骤②,向滤液I中加入适量![]() 溶液的目的是除去Cu2+和
溶液的目的是除去Cu2+和![]() ,其中除去Cu2+的离子方程式为______;加
,其中除去Cu2+的离子方程式为______;加![]() 之前需控制pH不能太低的目的是______。
之前需控制pH不能太低的目的是______。
(4)步骤③的目的是除去Fe和Cr,温度不能太高的原因是__。若在![]() 时,调
时,调![]() 除去铁,此时溶液中
除去铁,此时溶液中![]() __。
__。
(5)滤液Ⅲ中溶质的主要成分是______,检验滤液Ⅲ中是否还有铁元素的试剂是______。
(6)粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍,下列叙述正确的是__(已知:氧化性Fe2+<Ni2+<Cu2+)
A.粗镍作阳极,纯镍作阴极
B.阳极发生还原反应,其电极反应式:![]()
C.电解过程中,阳极质量的减少与阴极质量的增加相等
D.电解后,溶液中存在的金属阳离子只有Cu2+和![]()
E.电解后,电解槽底部的阳极泥中只有Cu和Pt
【答案】第四周期,第Ⅷ族 H-O-O-H 加热、搅拌、适当增大硫酸浓度等 Cu2++ S2-=CuS↓ 避免生成H2S,影响除杂 防止H2O2受热分解 2.64![]() 10-9mol/L NiSO4、Na2SO4、Cr2(SO4)3 KSCN溶液 AE
10-9mol/L NiSO4、Na2SO4、Cr2(SO4)3 KSCN溶液 AE
【解析】
由图可知,向废渣中加入硫酸酸浸,废渣中的镍单质等与硫酸反应得到硫酸盐溶液,调pH过滤得滤液I,加Na2S的目的是除去铜、锌等杂质,加H2O2、NaOH的目的是除去铁等杂质,加Na2CO3的目的是除去铬等杂质,因此推断滤液I的主要成分是NiSO4、CuSO4、ZnSO4、FeSO4、Cr2(SO4)3,滤液II的主要成分是NiSO4、FeSO4、Cr2(SO4)3、Na2SO4,滤液III的主要成分是NiSO4、Cr2(SO4)3、Na2SO4,据此解答。
(1) Ni的原子序数为28,电子排布式为1s22s22p63s23p63d84s2,则应位于第四周期,第Ⅷ族;H2O2分子中含有两个H-O键和一个O-O键。结构式为H-O-O-H,
故答案为:第四周期,第Ⅷ族;H-O-O-H;
(2) 根据化学反应速率的影响因素及规律可知,可以通过固体废渣的粉碎、搅拌、加热、适当增加硫酸浓度等手段达到目的,
故答案为:加热、搅拌、适当增大硫酸浓度等;
(3) Na2S是可溶性盐,溶于水时电离出S2-,S2-与Cu2+易反应生成CuS沉淀,离子方程式为Cu2++ S2-=CuS↓;加Na2S之前需控制pH不能太低,否则会生成H2S,不利于除杂,
故答案为:Cu2++ S2-=CuS↓;避免生成H2S,影响除杂;
(4) 步骤③中加入过氧化氢,反应温度不能过高,主要是避免H2O2受热分解而损失;
![]() ,
,![]() 的
的![]() ,pH=4时c(OH-)=10-10mol/L,则有c(Fe3+)
,pH=4时c(OH-)=10-10mol/L,则有c(Fe3+)![]() (10-10)3=2.64
(10-10)3=2.64![]() 10-39,c(Fe3+)=2.64
10-39,c(Fe3+)=2.64![]() 10-9mol/L,
10-9mol/L,
故答案为:防止H2O2受热分解;2.64![]() 10-9mol/L;
10-9mol/L;
(5)根据以上分析,滤液Ⅲ中溶质的主要成分是Na2SO4、NiSO4;检验滤液Ⅲ中是否还有铁元素的试剂是KSCN溶液,
故答案为:Na2SO4、NiSO4;KSCN溶液;
(6) A.电解精炼镍时,用粗镍作阳极,纯镍作阴极,故A正确;
B. 阳极发生氧化反应,其电极反应式:Ni-2e-=Ni2+,Fe-2e-=Fe2+;Zn-2e-=Zn2+,故B错误;
C. 电解过程中阳极失电子的有Fe、Zn、Ni;阴极析出的是镍;根据电子守恒,阳极质量的减少与阴极质量的增加不相等,故C错误;
D.电解时要用NiSO4作电解液,所以电解后,溶液中存在的金属阳离子除Cu2+和![]() 还有
还有
E. 粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和铂不失电子沉降电解池底部形成阳极泥,电解后,电解槽底部的阳极泥中只有Cu和Pt,故E正确。
故答案选AE。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】(1)BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及____________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为________,阴离子的中心原子轨道采用________杂化。
(2)已知苯酚(![]() )具有弱酸性,其Ka=1.1×10-10,水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10,水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2+3H22NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成![]() 键、
键、![]() 键、1molN≡N放出能量分别为436kJ、391kJ、946kJ。则:
键、1molN≡N放出能量分别为436kJ、391kJ、946kJ。则:
(1)若完全反应生成2mol![]() 可______
可______![]() 填“吸收”或“放出”
填“吸收”或“放出”![]() 热量______kJ。
热量______kJ。
(2)如果将![]() 和
和![]() 混合,使其充分反应,放出的热最总小于上述数值,其原因是______。
混合,使其充分反应,放出的热最总小于上述数值,其原因是______。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10min后,生成![]() ,则用
,则用![]() 表示的化学反应速率为______。
表示的化学反应速率为______。
(4)在四个不同容器中,不同条件下进行合成氨反应。根据在相同时内内测定的结果,判断该反应的速率由大到小的顺序是______![]() 用编号填写
用编号填写![]() 。
。
A.v(NH3)=0.5mol/(Lmin) B. v(H2)=0.3mol/(Lmin)
C.v(N2)=0.2mol/(Lmin) D. v(H2)=0.01mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对CH4与Cl2的反应(如图所示)叙述不正确的是
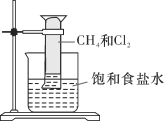
A. 该反应的生成物有四种
B. 该反应属于取代反应
C. 该反应的条件是光照
D. 该反应的现象是量筒内气体颜色变浅,器壁上有油状液滴,量筒内液面上升并产生白雾,溶液中有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的产物中,存在同分异构体的是
①CH3CH2CH2Br在碱性溶液中水解 ②甲苯在催化剂作用下与Cl2发生苯环上的取代反应 ③2-氯丁烷与NaOH乙醇溶液共热反应 ④ 在催化剂的存在与氢气完全加成 ⑤异戊二烯(
在催化剂的存在与氢气完全加成 ⑤异戊二烯( )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
A. ①②③ B. ①②④ C. ②③④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列5种基团中的2个不同基团两两组合,形成的有机物能与NaOH溶液反应的有
①-OH②-CH3③-COOH④![]() ⑤-CHO
⑤-CHO
A. 4种 B. 5种 C. 6种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定有机物A的结构,某研究团队对有机物A进行了多项实验,得实验结果如下:
①有机物A经李比希法分析知:含碳77.8%,氢为7.40%,其余为氧;
②质谱法分析A得知其相对分子质量为108;
③经红外光谱测定,A分子结构中含有苯环和羟基;
④A的核磁共振氢谱显示其有4种峰,且峰面积比为3∶2∶2∶1;
⑤A为无色晶体,常温下微溶于水;能与烧碱反应,且在常温下A可与浓溴水反应,1 mol A最多可消耗浓溴水中2 mol Br2。
求:(1)该有机物的分子式为________________。
(2)确定该有机物的结构简式:___________________,写出其与足量浓溴水反应的化学方程式:__________。
(3)含有苯环的A的同分异构体还有____________种(不含A),请写出其中属于醇的同分异构体与氧气加热(铜作催化剂)的反应方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.中和热测定:
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、________、________。
(2)量取反应物时,取50 mL 0.50 mol·Lˉ1的盐酸,还需加入的试剂是________(填序号)。
a.50 mL 0.50 mol·Lˉ1NaOH溶液
b.50 mL 0.55 mol·Lˉ1NaOH溶液
c.1.0 g NaOH固体
II.现用中和滴定测定某盐酸的浓度,有关数据记录如下:
滴定序号 | 待测液体积(mL) | 所消耗烧碱标准液的体积(mL) | ||
滴定前 | 滴定后 | 消耗的体积 | ||
1 | 25.00 | 0.50 | 25.12 | 24.62 |
2 | 25.00 | / | / | / |
3 | 25.00 | 5.00 | 29.58 | 24.58 |
(3)应用______式滴定管盛装0.2500 mol/L烧碱标准液,锥形瓶中装有25.00mL待测盐酸溶液。
(4)如图表示第二次滴定时50 mL滴定管中前后液面的位置。该次滴定所用标准烧碱溶液体积为_________mL。

(5)根据所给数据,计算出该盐酸的物质的量浓度(注意保留合适的有效数字),c (HCl) = _____________。
(6)读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果_________ (填“无影响”、“偏高”、“偏低”。下同);若装标准液的滴定管在装液前未用标准NaOH溶液润洗,会使最终测定结果_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com