
【题目】氮、磷、硼、砷的化合物用途非常广泛。根据所学知识回答下列问题:
(1)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a、b、c、d、e对应元素电负性最大的是__(用元素符号表示),e点代表的第三周期某元素的基态原子核外电子占据的最高能层符号为__,该能层具有的原子轨道数为__。

(2)已知反应:(CH3)3C-F+SbF5→(CH3)3CSbF6,该反应可生成(CH3)3C+,该离子中碳原子杂化方式有__。
(3)一种新型储氢化合物氨硼烷是乙烷的等电子体,且加热氨硼烷会慢慢释放氢气,推断氨硼烷的结构式为__(若含有配位键,要求用箭头表示)。
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198nm和206nm两种,这两种离子的化学式为__;正四面体形阳离子中键角大于PCl3的键角原因为___。
(5)砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:
B:(0,0,0);(![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() )
)
As:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() )
)
①请在图中画出砷化硼晶胞的俯视图__。

②与砷原子紧邻的硼原子有__个,与每个硼原子紧邻的硼原子有__个。
【答案】F M 9 sp3、sp2 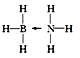 PCl4+、PCl6- 两者磷原子均采取sp3杂化,PCl3分子中P原子有一对孤电子对,孤电子和对成键电子对斥力更大,PCl4+中P没有孤电子对,正四面体形阳离子中键角大于PCl3的键角
PCl4+、PCl6- 两者磷原子均采取sp3杂化,PCl3分子中P原子有一对孤电子对,孤电子和对成键电子对斥力更大,PCl4+中P没有孤电子对,正四面体形阳离子中键角大于PCl3的键角  4 12
4 12
【解析】
(1)从图中可以看出,a、b、c、d都是第二周期元素的氢化物的沸点,由于NH3、H2O、HF分子间都能形成氢键,使它们的沸点升高,只有CH4分子间不能形成氢键,所以沸点最低,从而得出d为CH4的沸点,e为SiH4的沸点。在形成氢化物的分子中,HF形成氢键的能量最大,沸点最高。
(2) (CH3)3C+离子中,CH3-价电子对数为4,与3个-CH3相连的C,价电子对数为3,由此可确定碳原子杂化方式。
(3)氨硼烷是乙烷的等电子体,则氨硼烷的结构简式为H2NBH2,由此可推出其结构式。
(4)PCl5晶体中,正四面体形阳离子应为AB4+型,正八面体形阴离子应为AB6-型,由此可得出两种离子的化学式;正四面体形阳离子中键角大于PCl3的键角,其原因可从孤电子对的排斥作用进行分析。
(5)从砷化硼晶体中原子的分数坐标可以看出,B原子在立方体的顶点和面心:As原子在晶胞中的八个小立方体的体心。
①砷化硼晶胞的俯视图中,B原子位于正方形的中心、顶点和棱心,4个As原子位于对角线上,且离顶点四分之一处。
②与砷原子紧邻的硼原子位于小立体的体心,砷原子位于小立方体的顶点;与每个硼原子(设此硼原子在立方体的顶点)紧邻的硼原子在相交于此顶点的三个面心。
(1)由以上分析可知,d为CH4的沸点,e为SiH4的沸点。在形成氢化物的分子中,HF形成氢键的能量最大,沸点最高。从而得出a、b、c、d、e对应元素电负性最大的是F,在Si的基态原子中,核外电子占据的最高能层符号为M,该能层具有的原子轨道(包括3s、3p、3d所具有的轨道)数共为9。答案为:F;M;9;
(2) (CH3)3C+离子中,CH3-价电子对数为4,与3个-CH3相连的C,价电子对数为3,由此可确定碳原子杂化方式分别为sp3、sp2。答案为:sp3、sp2;
(3)氨硼烷是乙烷的等电子体,则氨硼烷的结构简式为H2NBH2,由此可推出其结构式为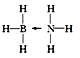 。答案为:
。答案为: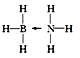 ;
;
(4)PCl5晶体中,正四面体形阳离子应为AB4+型,正八面体形阴离子应为AB6-型,由此可得出两种离子的化学式分别为PCl4+、PCl6-;正四面体形阳离子中键角大于PCl3的键角,其原因是:两者磷原子均采取sp3杂化,PCl3分子中P原子有一对孤电子对,孤电子和对成键电子对斥力更大,PCl4+中P没有孤电子对,正四面体形阳离子中键角大于PCl3的键角。答案为:PCl4+、PCl6-;两者磷原子均采取sp3杂化,PCl3分子中P原子有一对孤电子对,孤电子和对成键电子对斥力更大,PCl4+中P没有孤电子对,正四面体形阳离子中键角大于PCl3的键角;
(5)从砷化硼晶体中原子的分数坐标可以看出,B原子在立方体的顶点和面心:As原子在晶胞中的八个小立方体的体心。
①砷化硼晶胞的俯视图中,B原子位于正方形的中心、顶点和棱心,4个As原子位于对角线上,且离顶点四分之一处。则砷化硼晶胞的俯视图为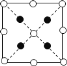 。答案为:
。答案为: ;
;
②与砷原子紧邻的硼原子位于小立体的体心,砷原子位于小立方体的顶点,则与砷原子紧邻的硼原子有4个;与每个硼原子(设此硼原子在立方体的顶点)紧邻的硼原子在相交于此顶点的三个面心,则与每个硼原子紧邻的硼原子有12个。答案为:4;12。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】如图所示为工业合成氨的流程图。有关说法不正确的是( )
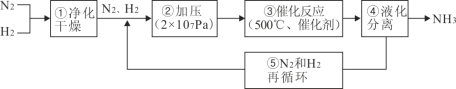
A.步骤①中“净化”可以防止催化剂中毒
B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C.产品液氨除可生产化肥外,还可用作制冷剂
D.步骤③、④、⑤均有利于提高原料平衡的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物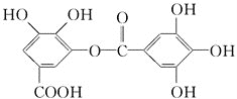 的叙述中,不正确的是( )
的叙述中,不正确的是( )
A.常温下,与NaHCO3溶液反应放出CO2气体
B.能发生碱性水解,1mol该有机物完全反应需要消耗8mol NaOH
C.与稀硫酸共热时,生成两种有机物
D.该有机物的分子式为C14H10O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
D. 苯甲醛、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液具有脱水性,和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色刺激性气味气体。上述物质的转化关系如图所示。下列说法正确的是( )

A.丁和戊中所含元素种类相同
B.简单离子半径大小:X<Y
C.气态氢化物的还原性:X>Z
D.Y的简单离子与Z的简单离子在水溶液中可大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过NO传感器可监测汽车排放尾气中NO含量,其工作原理如图所示,下列说法正确的是( )
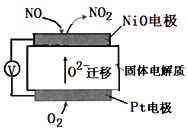
A.O2-由负极向正极移动
B.负极的电极反应式为:NO-2e-+O2-=NO2
C.O2在电极上的还原产物是H2O
D.反应消耗的NO与O2的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )
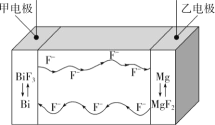
A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为
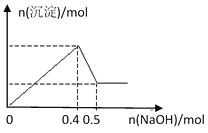
A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种环境激素,存在如图转化关系:
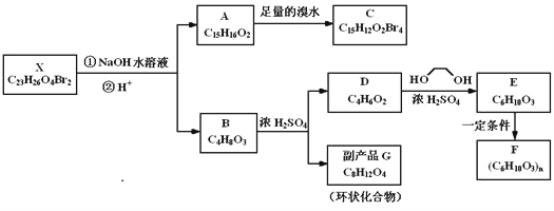
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1H﹣NMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。根据以上信息回答下列问题:
(1)下列叙述正确的是__;
a.化合物A分子中含有联苯结构单元
b.化合物A可以和NaHCO3溶液反应,放出CO2气体
c.X与NaOH溶液反应,理论上1mol X最多消耗6mol NaOH
d.化合物D能与Br2发生加成反应
(2)化合物C的结构简式是__,A→C的反应类型是__;
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构)__;
a.属于酯类 b.能发生银镜反应
(4)写出B→G反应的化学方程式__;
(5)写出E→F反应的化学方程式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com