
【题目】I、在一个固定体积的密闭容器中,加入2 mol A和1 mol B,发生反应:2A(g)+B(g)![]() 3C(g)+D(g),达到平衡时,C的浓度为W mol·L-1。若维持容器体积和温度不变,用下列物质作为起始反应物时,经反应达到平衡后C的浓度(用“大于”“小于”或“等于”表示)。
3C(g)+D(g),达到平衡时,C的浓度为W mol·L-1。若维持容器体积和温度不变,用下列物质作为起始反应物时,经反应达到平衡后C的浓度(用“大于”“小于”或“等于”表示)。
(1)加入1 mol A和1 mol B时,C的平衡浓度_________W mol·L-1。
(2)加入2mol A、1mol B、3mol C、1mol D时,C的平衡浓度_________W mol·L-1。
(3)加入3 mol C和1 mol D时,C的平衡浓度_________W mol·L-1。
II、现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“<”或“=”)。(下列空填“增大”“减小”或“不变”,)
(2)若加入B(体积不变),则A的转化率_________。
(3)若升高温度,则平衡时B、C的浓度之比 c(B)/c(C)将_________。
(4)若加入催化剂,平衡时气体混合物的总物质的量_________。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
【答案】 < > = 放 > 增大 减小 不变 变深 变浅
【解析】I、维持容器体积和温度不变,加入2mol A和1mol B,满足n(A)=2mol,n(B)=1mol,此时,C的浓度为W mol/L,只要是按照相同量的投料,建立的平衡即为等效平衡,(1)加入1mol A和1mol B时,和加入2mol A和1mol B相比较,相当于是减小A的投料,所以平衡逆向移动,C的浓度减小,即小于Wmol/L,故答案为:<;(2)加入2mol A、1mol B、3mol C、1mol D时,极限转化为A和B的量,相当于是加入4mol A、2mol B,此时C的平衡浓度增大,大于Wmol/L,故答案为:>;(3)加入3mol C和1mol D时,极限转化为A和B的量,相当于是加入2mol A、1mol B,两平衡等效,即C的平衡浓度等于Wmol/L,故答案为:=;II、(1)升高温度时,B的转化率变大,则升高温度平衡正向移动,该反应为吸热反应;减小压强时,混合体系中C的质量分数也减小,则减小压强平衡逆向移动,则m+n>p;(2)在反应容器中加入一定量的B,反应物B的浓度增大,平衡向正反应方向移动,则A的转化率增大;(3)正反应吸热,则升高温度平衡向正反应方向移动,B的物质的量减小,C的物质的量增多,所以二者的的浓度之比 c(B)/c(C)将减小;(4)若B是有色物质,A、C均无色,则加入C平衡向逆反应方向移动,B的浓度增大,则颜色加深,而维持容器内压强不变,充入氖气时,体积增大,对于反应体系来说,相当于减小压强,则平衡向逆反应方向移动,但移动的量远小于体积增大的因素,则B的浓度减小,颜色变浅。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】等体积的NaCl、MgCl2、AlCl3三种溶液分别与等体积等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液的物质的量浓度之比是
A. 1:1:1 B. 1:2:3 C. 3:2:1 D. 6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列溶液一段时间后再加入一定量的某种物质(方括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
A. AgNO3 [AgNO3] B. NaOH [H2O]
C. KCl [KCl] D. CuSO4 [Cu(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2===CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:A.乙醇、B.________、C.NaOH溶液。

(1)B中盛装的试剂是________________(填化学式)。
(2)A中加入乙醇的目的是___________________。
(二)探究草酸的酸性
将0.01 mol草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是________________________ (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
Ⅰ.实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸,反应原理:
![]() MnO
MnO![]() +
+![]() H2C2O4+
H2C2O4+![]() ____===
____===![]() Mn2++
Mn2++![]() CO2↑+
CO2↑+![]() H2O
H2O
(1)配平上述离子方程式。____________________
(2)滴定时KMnO4溶液应盛装于______________(填“酸式”或“碱式”)滴定管中。
Ⅱ.探究影响化学反应速率的因素
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
实验 组别 | c(H2C2O4) (mol·L-1) | V(H2C2O4) (mL) | c(KMnO4) (mol·L-1) | V(KMnO4) (mL) | c(H2SO4) (mol·L-1) | 褪色所 需时间 | 实验 目的 |
1 | 0.2 | 2 | 0.002 5 | 4 | 0.12 | 6′55″ | (a) |
2 | 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | |
3 | 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | |
4 | 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | |
5 | 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | |
6 | 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
请回答:
(1)实验目的(a)是___________________________________________。
(2)若要探究催化剂对该反应速率的影响,应选择MnSO4而不选MnCl2作为催化剂,其原因是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示,下列说法错误的是

A. 可利用KSCN溶液检验FeSO4溶液是否变质
B. 沉淀过程中有CO2气体放出
C. 过滤搡作的常用玻璃仪器有烧杯、漏斗和玻璃棒
D. 产品FeCO3在空气中高温分解可得到纯净的FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
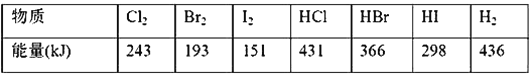
(1)下列物质本身具有的能量最低的是(____)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是(____)
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应? _____________。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的有几个
①苯的邻位二氯取代物只有一种②甲烷的二氯取代产物有两种③C3H8的二氯代物共有4种④可用酸性高锰酸钾溶液除去乙烷中的乙烯⑤分子式是C4H8的烃分子中一定含有碳碳双键⑥将苯滴入溴水中,振荡后水层接近无色是因为苯与溴水发生了取代反应⑦苯的同系物是分子中仅含有一个苯环的所有烃类物质⑧lmolCH5+中含11NA个电子⑨1mol-OH中含9NA个电子⑩菲的结构简式为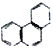 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
A. 2个 B. 3个 C. 4个 D. 5个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com