
【题目】(题文)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2===CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:A.乙醇、B.________、C.NaOH溶液。

(1)B中盛装的试剂是________________(填化学式)。
(2)A中加入乙醇的目的是___________________。
(二)探究草酸的酸性
将0.01 mol草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是________________________ (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
Ⅰ.实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸,反应原理:
![]() MnO
MnO![]() +
+![]() H2C2O4+
H2C2O4+![]() ____===
____===![]() Mn2++
Mn2++![]() CO2↑+
CO2↑+![]() H2O
H2O
(1)配平上述离子方程式。____________________
(2)滴定时KMnO4溶液应盛装于______________(填“酸式”或“碱式”)滴定管中。
Ⅱ.探究影响化学反应速率的因素
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
实验 组别 | c(H2C2O4) (mol·L-1) | V(H2C2O4) (mL) | c(KMnO4) (mol·L-1) | V(KMnO4) (mL) | c(H2SO4) (mol·L-1) | 褪色所 需时间 | 实验 目的 |
1 | 0.2 | 2 | 0.002 5 | 4 | 0.12 | 6′55″ | (a) |
2 | 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | |
3 | 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | |
4 | 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | |
5 | 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | |
6 | 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
请回答:
(1)实验目的(a)是___________________________________________。
(2)若要探究催化剂对该反应速率的影响,应选择MnSO4而不选MnCl2作为催化剂,其原因是_____________________________________________________________。
【答案】Ca(OH)2溶液或Ba(OH)2溶液除去H2C2O4,避免其对CO2的检验造成干扰C2O42-+H2O![]() HC2O
HC2O![]() +OH-2 5 6 H+ 2 10 8酸式探究高锰酸钾溶液浓度对化学反应速率的影响Cl-可与酸性KMnO4溶液发生氧化还原反应
+OH-2 5 6 H+ 2 10 8酸式探究高锰酸钾溶液浓度对化学反应速率的影响Cl-可与酸性KMnO4溶液发生氧化还原反应
【解析】
考查对草酸性质的探究实验的设计与评价,化学方程式的配平,气体的检验。(1)草酸分解的混合气体中含有未分解的草酸,草酸与氢氧化钙反应生成醋酸钙沉淀,干扰二氧化碳的检验;草酸是二元酸,与氢氧化钠反应时二者恰好完全反应,若草酸是强酸,则反应后的溶液为中性,现在溶液呈碱性,说明草酸为弱酸,草酸根离子水解,使溶液呈碱性;高锰酸根离子中Mn元素的化合价从+7价降低到+2价,得到5个电子,草酸中C元素的化合价从+3价升高到+4价,共失去2个电子,根据得失电子守恒完成;高锰酸钾的氧化性强,易腐蚀碱式滴定管的胶管,所以用酸式滴定管盛放高锰酸钾;由表中数据可知,草酸的浓度、体积都不变,稀硫酸的浓度不变,草酸的浓度变化,体积不变;因为高锰酸钾可以氧化氯离子为氯气,影响对催化剂对反应速率影响的探究。
(一)(1)草酸混合气体中含有未分解的草酸,草酸与氢氧化钙反应生成醋酸钙沉淀,干扰二氧化碳的检验,所以A中的乙醇目的是除去草酸,则B中的试剂是Ca(OH)2或Ba(OH)2溶液,目的是检验二氧化碳的存在,C中氢氧化钠的作用是除去二氧化碳,以便检验CO的存在;答案:Ca(OH)2溶液或Ba(OH)2溶液。
(2)A中乙醇的目的是除去H2C2O4,避免对CO2的检验造成干扰;答案:除去H2C2O4,避免其对CO2的检验造成干扰。
(二)草酸是二元酸,与氢氧化钠反应时二者恰好完全反应,若草酸是强酸,则反应后的溶液为中性,现在溶液呈碱性,说明草酸为弱酸,草酸根离子水解,使溶液呈碱性,离子方程式为C2O42-+H2O![]() HC2O
HC2O![]() +OH-;答案:C2O42-+H2O
+OH-;答案:C2O42-+H2O![]() HC2O
HC2O![]() +OH-。
+OH-。
(三)I.(1)高锰酸根离子中Mn元素的化合价从+7价降低到+2价,得到5个电子,草酸中C元素的化合价从+3价升高到+4价,共失去2个电子,根据得失电子守恒,则高锰酸根离子的系数是2,草酸的系数是5,根据元素守恒配平Mn2+、CO2的系数,最后根据电荷守恒配平氢离子、水的系数。所以答案为2 5 6 H+ 2 10 8。
(2)高锰酸钾的氧化性强,所以不能用碱式滴定管,易腐蚀碱式滴定管的胶管,所以用酸式滴定管盛放高锰酸钾;答案:酸式。
II.(1)由表中数据可知,草酸的浓度、体积都不变,稀硫酸的浓度不变,高锰酸钾的浓度变化,体积不变,所以褪色所需时间就不同,所以a的目的是探究高锰酸钾溶液浓度对化学反应速率的影响。答案:探究高锰酸钾溶液浓度对化学反应速率的影响。
(2)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,是因为高锰酸钾具有强氧化性,可以氧化氯离子为氯气,影响催化剂对反应速率影响的探究。答案:Cl-可与酸性KMnO4溶液发生氧化还原反应。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.钠保存在煤油中
B.氯水保存在棕色试剂瓶中
C.Na2O2需要隔绝空气密封保存
D.实验室盛装NaOH溶液的试剂瓶用玻璃塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中存在大量的Ba2+、NH4+、Cl-,该溶液中还可能大量存在的离子是( )
A. Fe3+B. CO32-C. Mg2+D. OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。回答下列问题:
(1)氨气的制备

①氨气制取的发生装置可以选择上图中的_________(填字母),反应的化学方程式为____________________。
②选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:发生装置→______→______,______→_____→i(按气流方向,用小写英文字母表示)。
③可用如装置进行氨的喷泉实验,引发喷泉的操作是__________。

(2)如图所示,NH3经一系列反应可以得到HNO3。

①反应①的化学方程式为________________________________________。
②产物NO是大气污染物之一。在400℃左右且有催化剂存在的情况下,可用氨将一氧化氮还原为无色无毒气体。该反应的化学方程式为_______________________。
(3)在某100mL硝酸与硫酸的混合液中,HNO3和H2SO4的物质的量浓度分别为0.6 mol·L-1和0.3mol·L-1。向该混合液中加入3.84g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是多少____________?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是
A. 用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+=Cu2+ + 2Fe2+
B. 氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
C. 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓
D. 碳酸钠溶液中逐滴加入少量的盐酸:2H+ + CO32-=CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
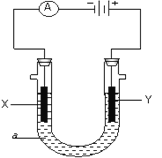
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则可观察到在X极附近观察到的现象是__________电极反应式是________________检验Y电极反应产物的方法是____________________电解一段时间之后溶液的PH将会________(升高、降低或不变),总方程式为_________________________。
(2)若X、Y都是铜电极,a是稀CuSO4溶液,开始实验,X极的电极反应式是__________________________。电解前后CuSO4溶液的浓度___________________(变大、变小或不变)若X电极质量增重64克,则在电路中有_________________mol的电子发生转移。
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则①X电极的材料是_____,电极反应式是_____________。②Y电极的材料是______,电极反应式是____________________。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在一个固定体积的密闭容器中,加入2 mol A和1 mol B,发生反应:2A(g)+B(g)![]() 3C(g)+D(g),达到平衡时,C的浓度为W mol·L-1。若维持容器体积和温度不变,用下列物质作为起始反应物时,经反应达到平衡后C的浓度(用“大于”“小于”或“等于”表示)。
3C(g)+D(g),达到平衡时,C的浓度为W mol·L-1。若维持容器体积和温度不变,用下列物质作为起始反应物时,经反应达到平衡后C的浓度(用“大于”“小于”或“等于”表示)。
(1)加入1 mol A和1 mol B时,C的平衡浓度_________W mol·L-1。
(2)加入2mol A、1mol B、3mol C、1mol D时,C的平衡浓度_________W mol·L-1。
(3)加入3 mol C和1 mol D时,C的平衡浓度_________W mol·L-1。
II、现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“<”或“=”)。(下列空填“增大”“减小”或“不变”,)
(2)若加入B(体积不变),则A的转化率_________。
(3)若升高温度,则平衡时B、C的浓度之比 c(B)/c(C)将_________。
(4)若加入催化剂,平衡时气体混合物的总物质的量_________。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com