
【题目】在正规化学试卷的开始处总有“可能用到的相对原子质量”一项,如H:1 C:12 Cl:35.5 S:32 Cu:64等。请问这些数值准确的说法应该是
A. 某种核素的相对原子质量
B. 某种核素的原子质量
C. 某种元素的平均相对原子质量
D. 某种元素的平均相对原子质量的近似值
【答案】D
【解析】试题分析:某种核素的相对原子质量、原子质量仅代表一种核素,不能代表某种元素的全部核素,在正规化学试卷的开始处总有“可能用到的相对原子质量”,是元素的相对原子质量的近似值,按各种天然同位素原子所占的一定百分比算出来的平均值的近似值,不是平均相对原子质量,答案选D。
原子质量 | 原子的相对原子质量 | 元素的相对原子质量 | 质量数 | |
定义 | 指某元素某种核素的一个原子的真实质量 | 一个原子的真实质量与一个 | 该元素各种核素原子的相对原子质量与其在自然界中所占原子个数百分比的乘积之和 | 一个原子核内质子数与中子数的和 |
实例 | 一个 |
| Mr=Mr1a%+Mr2b%+…(其中a%+b%+…=1) |
|


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】石油分流产品正丁烷可以按以下合成路线进行转化(生成物中的无机物忽略)

提示:
问题:
(1)D中所含官能团的名称:_____________
(2)下列反应中属于取代反应的是:______________
A.① B.② C.④ D.⑤
(3)写出反应⑦的化学方程式:________________
写出反应⑧的化学方程式:___________________
(4)高聚物X的结构简式:_________________
(5)A是直链结构,可以使Br2的CCl4溶液褪色,生成的产物最多有__________种
(6)与G具有相同官能团的同分异构体有___________种
(7)反应③的目的是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016海南]下列有关实验操作的叙述错误的是
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol·L-1
mol·L-1
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列叙述中正确的是
A.纤维素在人体内可水解为葡萄糖,故可用作人体的营养物质
B.补钙剂中常含有维生素D,其作用是为了促进钙的吸收
C.天然存在的动植物油脂,大多属于单甘油酯
D.蛋白质的盐析属于化学变化,可用于分离、提纯蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH(固体) ②H2O ③HCl ④CH3COONa(固体)
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的相对分子质量与X最最高价氧化物的相对分子质量之比为17:40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子.试回答:
(1)写出各元素名称:X______、Y______、Z______.
(2)X离子的结构简式图为_________,X与Y形成的离子化合物的化学式为______,Z与氢形成的化合物的化学式 ______.
(3)Y单质在空气中燃烧产物与水反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为______________,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
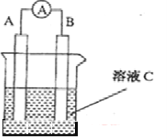
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为________________。
(3)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为________________,电池总反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可以发生如下反应:NaCN+HNO2=HCN+NaNO2;NaCN+HF=HCN+NaF ; NaNO2+HF=HNO2+NaF , 由此可判断下列叙述中正确的是
A. HNO2的电离平衡常数是③ B. HNO2的电离平衡常数是①
C. HCN的电离平衡常数是② D. HF的电离平衡常数是①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com