
【题目】把由NaOH、![]() 、
、![]() 三种固体组成的混合物溶于足量的水中,有
三种固体组成的混合物溶于足量的水中,有![]() 白色沉淀析出,向所得的浑浊液中逐滴加入
白色沉淀析出,向所得的浑浊液中逐滴加入![]() 的盐酸,加入盐酸的体积和生成沉淀的质量如图所示。
的盐酸,加入盐酸的体积和生成沉淀的质量如图所示。
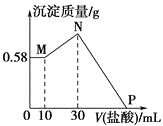
(1)混合物中NaOH的质量是________g,![]() 的质量是________g,
的质量是________g,![]() 的质量是________g。
的质量是________g。
(2)![]() 点加入盐酸的体积为________mL。
点加入盐酸的体积为________mL。
【答案】![]()
![]()
![]() 1
1![]()
【解析】
(1)利用镁元素守恒计算出氯化镁的质量,氢氧化钠分三部分反应,一部分与盐酸中和,一部分与氯化铝反应,一部分与氯化镁反应,三者相加得到氢氧化钠的物质的量,再换算成为质量,氯化铝的质量利用铝元素守恒计算;
(2)P点溶液为MgCl2、AlCl3和NaCl混合液,由氯离子守恒可知,氯化钠中氯离子源于加入盐酸,根据钠离子守恒可知n(NaOH)=n(NaCl),进而计算加入盐酸的体积。
![]() NaOH、
NaOH、![]() 、
、![]() 三种固体组成的混合物溶于足量的水中, 0到10mL加入酸后M沉淀不变,发生酸碱中和,说明溶液中氢氧化钠过量,不会存在氢氧化铝,形成的沉淀只能是
三种固体组成的混合物溶于足量的水中, 0到10mL加入酸后M沉淀不变,发生酸碱中和,说明溶液中氢氧化钠过量,不会存在氢氧化铝,形成的沉淀只能是![]() ,说明是,
,说明是,![]() 的质量为
的质量为![]() ,即
,即![]() ,因此
,因此![]() ,所以
,所以![]() 的质量为
的质量为![]() ;生产氢氧化镁消耗的氢氧化钠的物质的量
;生产氢氧化镁消耗的氢氧化钠的物质的量![]() ,开始至加入
,开始至加入![]() 盐酸,发生反应:
盐酸,发生反应:![]() ,
,![]() ,盐酸的加入量从
,盐酸的加入量从![]() 发生反应:
发生反应:![]() ,
,![]() ,因此
,因此![]() ,所以
,所以![]() 的质量为
的质量为![]() ;
;
根据反应:![]() ,
,![]() ;NaOH的质量是
;NaOH的质量是![]() ;
;
![]() 根据反应:
根据反应:![]() ,
,![]() ,
,![]() ,
,![]() ,P点加入盐酸的体积为
,P点加入盐酸的体积为![]() 。
。


科目:高中化学 来源: 题型:
【题目】为分析某有机化合物A的结构,进行了如下实验:
(1)向NaHCO3溶液中加入A,有气体放出,说明A中含有___________官能团(写结构简式)。
(2)向NaOH溶液中加入少许A,加热一段时间后,冷却,用HNO3酸化后再滴加AgNO3溶液,产生淡黄色沉淀,说明中A还有___________官能团(写名称)。
(3)经质谱分析,Mr(A)=153,且A中只有四种元素,则A的分子式为___________。
(4)核磁共振氢谱显示,A的氢谱有3种,其强度之比为1︰2︰2,则A结构简式为___________。
(5)已知A可发生如下图所示的转化:
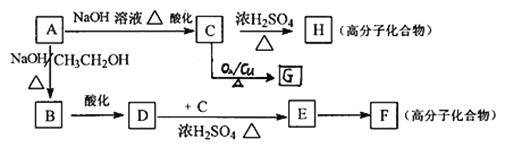
①A→B、D→E的反应类型分别为___________、___________。
②写出下列反应的化学方程式C→H:_________________________。
③C的同分异构体有多种,写出与C具有相同的官能团的C的同分异构体的结构简式:___________________________;写出F的结构简式:________________________。
④G与过量的银氨溶液反应,每生成2.16gAg,消耗G的物质的量是__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl—)与c(SO42—)之比为( )

A. 1∶1 B. 2∶3 C. 3∶2 D. 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃,将amolN2和bmolO2充入体积为IL的密闭容器中发生反应: N2(g)+O2(g)=2NO(g)△H=181.5kJ/mol,反应过程中v正与v逆的变化如图所示。下列说法正确的是

A.若t1时NO为cmol,则0~t1时间段内平均反应速率v(N2)=
B.t1~t2时间段内v正(O2)=2v逆(NO)
C.图中所示的阴影部分面积的含义是v正与v逆的差
D.其他条件不变,t2时刻升高温度,v正与v逆均增大,且v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是
A. 如图表示向含
如图表示向含![]() 、
、![]() 、
、![]() 的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积关系图.则三种离子的物质的量之比为:
的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积关系图.则三种离子的物质的量之比为:![]() :
:![]() :
:![]()
![]() :1:2,其中使用的NaOH的浓度为2
:1:2,其中使用的NaOH的浓度为2![]()
B. 如图中曲线表示某反应过程的能量变化,当物质
如图中曲线表示某反应过程的能量变化,当物质![]() 与
与![]() 反应生成物质
反应生成物质![]() 是,
是,![]() ,若使用正催化剂,E值会减小
,若使用正催化剂,E值会减小
C.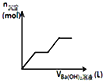 如图可用来表示向盐酸酸化的
如图可用来表示向盐酸酸化的![]() 溶液中加入
溶液中加入![]() 溶液时,产生沉淀的物质的量
溶液时,产生沉淀的物质的量![]() 与加入
与加入![]() 溶液体积
溶液体积![]() 之间的关系图
之间的关系图
D. 如图表示向一定质量的明矾溶液中滴加
如图表示向一定质量的明矾溶液中滴加![]() 溶液时,产生沉淀的质量
溶液时,产生沉淀的质量![]() 与加入
与加入![]() 溶液体积
溶液体积![]() 之间的关系图
之间的关系图
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温、常压下,50 mL三种气态烃的混合物与足量的氧气混合后点燃爆炸,恢复到原来状况时,体积共缩小100 mL,则三种烃可能是
A.CH4、C2H6、C3H4B.C2H6、C3H6、C4H6
C.CH4、C2H6、C3H8D.C2H4、C2H6、C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有12mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体,则原混合气体中O2的体积和剩余的2mL气体可能分别是
A.1.2mL,NOB.2.4mL,O2
C.3.5mL,O2D.4mL,NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用亚硫酸钠固体和70%的浓硫酸制备SO2气体,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,请设计一套实验装置,收集一试管干燥的SO2气体。
(1)在下面方框中,A表示由分液漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,尾气处理部分必须画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其它可选用的仪器(数量不限)简易表示如下:___

(2)根据方框中的装置图甲,在答题卡上填写下表(可不填满)___
仪器标号 | 仪器中所加物质 | 作用 |
A | 亚硫酸钠、浓硫酸 | 产生SO2 |
(3)某实验小组用如图乙装置测定收集到的气体中SO2的含量,反应管中装有酸性高猛酸钾溶液。
①SO2和酸性高猛酸钾溶液发生反应的离子方程式为:___。
②反应管内溶液紫红色消失后,若没有及时停止通气,则测得的SO2含量___(选填:“偏高”、“偏低”或“无影响”)
③若酸性高猛酸钾溶液体积为V1mL,浓度为cmol/L,量气管内增加的水的体积为V2mL(已折算成标准状况下的体积)。用c、V1、V2表示SO2的体积百分含量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A. 在t ℃时,AgBr的Ksp为4.9×10-13
B. 通过蒸发,可使溶液由a点变到c点
C. 图中b点有AgBr沉淀析出
D. 在t ℃时,AgCl(s)+Br-(aq) ![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com