
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl—)与c(SO42—)之比为( )

A. 1∶1 B. 2∶3 C. 3∶2 D. 2∶1
【答案】B
【解析】试题分析:设氢氧化钠物质的量浓度为1mol/L,首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为0.25V,物质的量为0.25Vmol,则n(Al3+)=0.25Vmol,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的物质的量为0.25Vmol×3=0.75Vmol,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液V,计算沉淀Mg2+消耗的氢氧化钠溶液的物质的量为Vmol-0.75molV=0.25Vmol,则n(Mg2+)=0.125Vmol,n(Cl-)=0.25Vmol;n(Al3+)=0.25Vmol,n(SO42-)=![]() n(Al3+)=
n(Al3+)=![]() ×0.25Vmol,溶液中c(Cl-):c(SO42-)=n(Cl-):n(SO42-)=0.25Vmol:
×0.25Vmol,溶液中c(Cl-):c(SO42-)=n(Cl-):n(SO42-)=0.25Vmol: ![]() ×0.25Vmol=2:3,故选B。
×0.25Vmol=2:3,故选B。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是:
A.2SO2+O2![]() 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:25℃时,CaCO3的Ksp=2.8×10-9,现将Na2CO3浓度为2×10-4mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应大于
A. 2.8×10-2mol·L-1 B. 5.6×10-5mol·L-1
C. 2.8×l0-5 mol·L-1 D. 1.4×l0-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是一种非常活泼、具有广泛应用的金属。
(1)钠的原子结构示意图为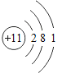 ,钠在反应中容易___电子(填“得到”或“失去”)。
,钠在反应中容易___电子(填“得到”或“失去”)。
(2)金属钠非常活泼,通常保存在________里,以隔绝空气。
(3)汽车安全气囊的气体发生剂NaN3可由金属钠生产。某汽车安全气囊内含NaN3、Fe2O3和NaHCO3等物质。
ⅰ.当汽车发生较严重的碰撞时,引发NaN3分解2NaN3 = 2Na + 3N2,从而为气囊充气。N2的电子式为_________。
ⅱ.产生的Na立即与Fe2O3发生置换反应生成Na2O,化学方程式是________。
ⅲ.NaHCO3是冷却剂,吸收产气过程释放的热量。NaHCO3起冷却作用时发生反应的化学方程式为________。
ⅳ.一个安全气囊通常装有50 g NaN3,其完全分解所释放的N2为_______mol。
(4)工业通过电解NaCl生产金属钠:2NaCl(熔融)![]() 2Na+Cl2,过程如下:
2Na+Cl2,过程如下:
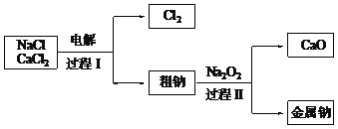
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入CaCl2从而把熔点降至约580℃。
①把NaCl固体加热至熔融状态,目的是________。
②电解时,要避免产生的Na与Cl2接触而重新生成NaCl。用电子式表示NaCl的形成过程________。
③粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是________。
④过程Ⅰ中,CaCl2能发生像NaCl那样的电解反应而被消耗。但在过程Ⅰ中CaCl2却不断地被重新生成,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。
(1)氯胺(NH2Cl)的电子式为___。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=___。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/(kJ·mol-1) | 391 | 243 | 191 | 431 |
(2)液氨中存在电离平衡2NH3(l)![]() NH
NH![]() +NH
+NH![]() ,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是___。
,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是___。
(3)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
t/min | 0 | 20 | 40 | 60 | 80 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为___(填“放热”或“吸热”)反应,理由是___;
②下列选项中可以说明容器乙已经达到平衡状态的是___(填序号)
A.容器内压强不变
B.容器内气体的密度不变
C.2υ正(NO)=υ逆(N2)
D.混合气体的平均摩尔质量不变
③乙容器在100min达到平衡状态,则0~100min内用NO的浓度变化表示的平均反应速率υ(NO)=___,平衡常数K(400℃)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素的原子半径的相对大小、最高正价或最低负价的变化如下图所示,下列分析正确的是( )
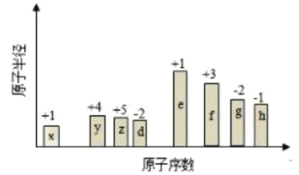
A.![]() 、
、![]() 的简单离子半径大小:
的简单离子半径大小:![]()
B.元素的金属性:![]()
C.元素的非金属性:![]()
D.![]() 、
、![]() 、
、![]() 和
和![]() 四种元素能形成离子化合物
四种元素能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种重要的有机合成原料,其球棍模型如图甲所示。该化合物可用芳香烃A为原料来合成,其合成路线如图乙所示:
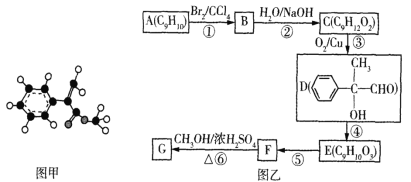
(1)下列关于G的说法不正确的是___(填标号)。
a.G的结构简式为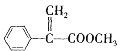
b.G能使酸性高锰酸钾溶液和溴水褪色,褪色原理相同
c.G的分子中所有碳原子可能处于同一平面内
d.G在一定条件下能发生水解、加成、加聚、氧化等反应
(2)F中的官能团名称为___,E的结构简式为___。
(3)反应①~⑥中属于取代反应的有___(填标号)。
(4)D的核磁共振氢谱的峰面积之比为____。
(5)写出D与银氨溶液反应的化学方程式:____。
(6)写出同时符合下列条件的F的同分异构体的结构简式:___(不考虑立体异构)。
a.分子内含苯环
b.苯环上只有一个支链
c.能发生银镜反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是( )
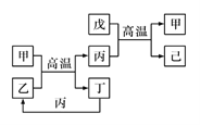
A.W的原子半径大于Z,金属性强于Z
B.W元素在周期表中的位置是第四周期VIIIB族
C.可以通过电解熔融的己来制备戊
D.X和Y形成的化合物中只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,指定的离子组一定能大量共存的是( )
A.无色溶液中:K+、Cu2+、Cl-、SO![]()
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO![]()
C.在pH=1的溶液中:K+、Ba2+、Cl-、NO![]()
D.室温下,![]() =10-13的溶液中:Na+、Fe3+、NO
=10-13的溶液中:Na+、Fe3+、NO![]() 、SO
、SO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com