
【题目】随原子序数的递增,八种短周期元素的原子半径的相对大小、最高正价或最低负价的变化如下图所示,下列分析正确的是( )
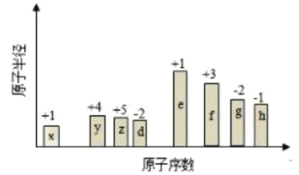
A.![]() 、
、![]() 的简单离子半径大小:
的简单离子半径大小:![]()
B.元素的金属性:![]()
C.元素的非金属性:![]()
D.![]() 、
、![]() 、
、![]() 和
和![]() 四种元素能形成离子化合物
四种元素能形成离子化合物
科目:高中化学 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )
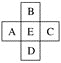
A. 4xB. 4x+14
C. 4x+10D. 4x+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以不同类别物质间的转化为线索,认识钠及其化合物。
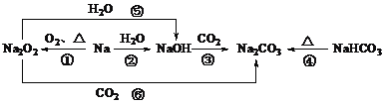
下列分析不正确的是
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明NaHCO3的稳定性强于Na2CO3
C.反应⑤、⑥可用于潜水艇中氧气的供给
D.上述转化中发生的反应有分解反应、化合反应、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在含有生命元素硒(![]() )的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
)的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
A.硒单质在常温下是固体
B.硒的气态氢化物稳定性比![]() 强
强
C.硒是金属元素
D.硒酸(![]() )的酸性比硫酸强
)的酸性比硫酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl—)与c(SO42—)之比为( )

A. 1∶1 B. 2∶3 C. 3∶2 D. 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“索尔维制碱法”工艺流程如图所示,请回答下列问题:
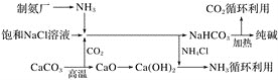
(1)向饱和氯化钠溶液中先通入___,效果更好。反应制得NaHCO3沉淀和NH4Cl溶液的化学方程式为____。
(2)索尔维制碱法除了得到纯碱外,还会产生一种废渣___。侯氏制碱法在此工艺上改进,不再使用碳酸钙制备CO2,而是在制备NH3的过程中制得CO2,则侯氏制碱法在得到纯碱的同时还制得了___,此物质在农业上的用途是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁是常见的金属,其化合物也有广泛的用途。回答下列问题:
(1)氢氧化铝是一种两性氢氧化物,写出它的电离方程式___,将少量的稀盐酸逐渐滴入NaAlO2溶液,产生的现象为___,用平衡移动原理来解释这一现象:___。
(2)明矾可以用于净水,用离子反应方程式来解释原理:___,将Ba(OH)2溶液滴入明矾溶液中,当SO42-完全沉淀,则铝元素在溶液中存在的形式为___(用化学式表示)。
(3)高铁酸钠(Na2FeO4)可用作高效水处理剂,既可以杀菌消毒,又可以除去水中的悬浮颗粒物,请用你所学过的化学原理加以解释。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Na2O2与H2O反应:2O![]() +2H2O===O2↑+4OH-
+2H2O===O2↑+4OH-
B.向Fe2(SO4)3溶液中加入足量Cu粉:2Fe3++3Cu===2Fe+3Cu2+
C.向NaHSO4溶液中加入Ba(OH)2溶液至中性:2H++SO![]() +Ba2++2OH-===BaSO4↓+2H2O
+Ba2++2OH-===BaSO4↓+2H2O
D.向银氨溶液中加入足量盐酸:[Ag(NH3)2]++2H+===Ag++2NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在1L的密闭容器中充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
CH3OH(g)+H2O(g)H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
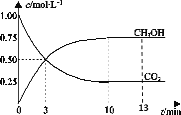
A.T℃时,平衡常数K=3,CO2与H2的平衡转化率相等
B.T℃时,上述条件下达到平衡时放出49.0kJ的热量
C.降温和缩小容器体积均可使反应的平衡常数增大
D.从反应开始到3min,H2的平均反应速率υ(H2)=0.5molL-1min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com