
【题目】以不同类别物质间的转化为线索,认识钠及其化合物。
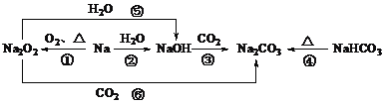
下列分析不正确的是
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明NaHCO3的稳定性强于Na2CO3
C.反应⑤、⑥可用于潜水艇中氧气的供给
D.上述转化中发生的反应有分解反应、化合反应、置换反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】五氧化二钒常用作化学工业中的催化剂,广泛用于冶金、化工生产。一种以钒渣(主要含有V2O3,还有少量FeO、Al2O3、SiO2等)为原料生产V2O5的工艺流程如图:

已知:VO![]() +H2O
+H2O![]() VO
VO![]() +2H+
+2H+
(1)“焙烧”时,V2O3转化为NaVO3的化学方程式是___。
(2)滤渣1为___(填化学式),“酸浸”后,调pH=7.6,除了得到沉淀Fe(OH)3、___,另一个目的是___。
(3)“沉钒”得到偏钒酸铵(NH4VO3)的离子方程式是___。图1是沉钒率随温度的变化曲线,温度高于80℃,沉钒率下降,其可能原因是___。
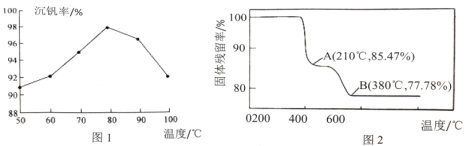
(4)在“煅烧”过程中,固体残留率(剩余固体质量/原始固体质量x100%)随温度变化的曲线如图2所示。NH4VO3分解过程中,先后失去的物质分别是___、___。(填化学式)
(5)金矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+![]() VO2++H2O+V3+,电池充电时,阳极的电极反应式为___。
VO2++H2O+V3+,电池充电时,阳极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,试回答:
Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,试回答:
(1)增加Fe的物质的量,其正反应速率___________。
(A.变快B.不变C变慢,填字母代号)。
(2)将容器的体积缩小一半,其正反应速率___________,逆反应速率___________。
(3)若保持体积不变,充入Ar,其逆反应速率___________。
(4)保持压强不变,充入Ar,其正反应速率___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是

A. 加入Na2SO4可使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:25℃时,CaCO3的Ksp=2.8×10-9,现将Na2CO3浓度为2×10-4mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应大于
A. 2.8×10-2mol·L-1 B. 5.6×10-5mol·L-1
C. 2.8×l0-5 mol·L-1 D. 1.4×l0-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铁是重要的还原剂,常用于检测硒、生产聚合氯化铝铁絮凝剂。制备FeCl2的方法有多种。请回答下列问题:
Ⅰ.结晶法制取FeCl2
在一定浓度的盐酸中,逐渐加入过量的铁屑,充分反应后,蒸发至出现晶膜,____,______,固液分离,洗涤,快速干燥制得。
Ⅱ.氯苯还原无水FeC13制取FeC12
无水FeCl3与氯苯反应的化学方程式为:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑
2FeCl2+C6H4Cl2+HCl↑
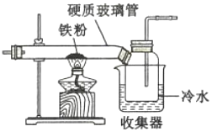
(1)如图是用干燥的C12和铁粉制取无水FeC13的装置。硬质玻璃管和收集器用大口管连接的原因是________。
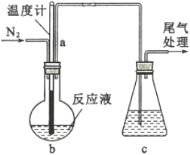
(2)利用如图装置制备无水FeC12,并检测FeC13的转化率。已知相关物质的部分性质如下:
C6H5C1(氯苯) | C6H4C12 | FeC13 | FeC12 | |
相对分子质量 | 112.5 | 147 | 162.5 | 127 |
熔点/℃ | -45 | 53 | 306 | 670~674 |
沸点/℃ | 132 | 173 | 315 | 1023 |
将162.5 g无水氯化铁和200 g氯苯加入到圆底烧瓶中,在锥形瓶中加入200 g滴有酚酞的9.5%的NaOH溶液。先通入N2一段时间,再加热,控制温度在132 ℃左右发生反应。实验完成后冷却,分离提纯得到粗产品。
①先通入N2的目的是_______;导管a的作用是______。
②当锥形瓶内溶液颜色由红色变为无色时,停止加热,则氯化铁转化率理论上达到或超过______%。
③实验结束后,回收过量氯苯的操作名称为______。
④指出装置c可能存在的缺点______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是一种非常活泼、具有广泛应用的金属。
(1)钠的原子结构示意图为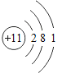 ,钠在反应中容易___电子(填“得到”或“失去”)。
,钠在反应中容易___电子(填“得到”或“失去”)。
(2)金属钠非常活泼,通常保存在________里,以隔绝空气。
(3)汽车安全气囊的气体发生剂NaN3可由金属钠生产。某汽车安全气囊内含NaN3、Fe2O3和NaHCO3等物质。
ⅰ.当汽车发生较严重的碰撞时,引发NaN3分解2NaN3 = 2Na + 3N2,从而为气囊充气。N2的电子式为_________。
ⅱ.产生的Na立即与Fe2O3发生置换反应生成Na2O,化学方程式是________。
ⅲ.NaHCO3是冷却剂,吸收产气过程释放的热量。NaHCO3起冷却作用时发生反应的化学方程式为________。
ⅳ.一个安全气囊通常装有50 g NaN3,其完全分解所释放的N2为_______mol。
(4)工业通过电解NaCl生产金属钠:2NaCl(熔融)![]() 2Na+Cl2,过程如下:
2Na+Cl2,过程如下:
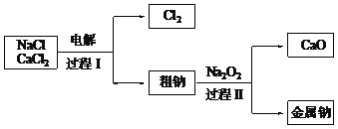
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入CaCl2从而把熔点降至约580℃。
①把NaCl固体加热至熔融状态,目的是________。
②电解时,要避免产生的Na与Cl2接触而重新生成NaCl。用电子式表示NaCl的形成过程________。
③粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是________。
④过程Ⅰ中,CaCl2能发生像NaCl那样的电解反应而被消耗。但在过程Ⅰ中CaCl2却不断地被重新生成,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素的原子半径的相对大小、最高正价或最低负价的变化如下图所示,下列分析正确的是( )
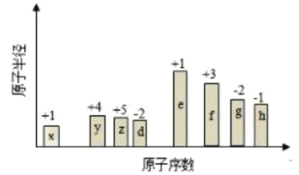
A.![]() 、
、![]() 的简单离子半径大小:
的简单离子半径大小:![]()
B.元素的金属性:![]()
C.元素的非金属性:![]()
D.![]() 、
、![]() 、
、![]() 和
和![]() 四种元素能形成离子化合物
四种元素能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、

试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式___。
(2)装置B的作用是①__,②___。
(3)若用A装置制取NO气体,B中应该盛放__。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为__。
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与__同时通入NaOH溶液中。
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:__。(仅提供的试剂:1molL-1HCl、1molL-1HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20molL-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用___做指示剂。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com