
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、

试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式___。
(2)装置B的作用是①__,②___。
(3)若用A装置制取NO气体,B中应该盛放__。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为__。
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与__同时通入NaOH溶液中。
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:__。(仅提供的试剂:1molL-1HCl、1molL-1HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20molL-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用___做指示剂。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为__。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去挥发的HCl气体 平衡容器内压强 H2O 2:1 O2 用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸上,试纸变蓝,说明HNO2是弱酸 K2CrO4溶液 87.3%
Mn2++Cl2↑+2H2O 除去挥发的HCl气体 平衡容器内压强 H2O 2:1 O2 用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸上,试纸变蓝,说明HNO2是弱酸 K2CrO4溶液 87.3%
【解析】
由题中信息可知,该实验先制备氯气,然后在反应容器中与NO反应生成ClNO,经冰盐冷凝得到液态的ClNO,尾气用氢氧化钠溶液吸收。测定样品纯度时,根据守恒法可以找到样品与标准溶液之间的关系进行计算。
(1)实验室利用装置A、用二氧化锰和浓盐酸共热制备Cl2,该反应离子反应方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)A装置制备的氯气中含有氯化氢气体,反应过程中系统内的压强会发生变化,因此,装置B的作用有两个:①除去挥发的HCl气体;②平衡容器内压强。
(3)若用A装置制取NO气体,装置内的空气可将NO氧化成NO2,由于NO2可以与水反应生成NO,所以B中应该盛放水。
(4)为使NO和Cl2恰好完全反应生成ClNO,根据两者反应的化学方程式2NO+Cl2=2ClNO可知,理论上向E中通入NO和Cl2两种气体的流速比为2:1。
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收,该气体为NO,因为NO不与氢氧化钠溶液反应,也不溶于其中。由于NO和O2按一定比例混合后可以被NaOH溶液完全吸收,因此,为了充分吸收尾气,可将尾气与O2同时通入NaOH溶液中。
(6)①根据弱酸强碱盐水解可以使其溶液显碱性,石蕊遇碱变为红色,再根据所提供的试剂,可以设计证明HNO2是弱酸的方案是:用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸上,试纸变蓝,说明HNO2是弱酸。
②已知ClNO与H2O反应生成HNO2和HCl。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20molL-1AgNO3标准溶液滴定至终点,根据表中所给信息可知,AgI 和Ag2S的溶解度均小于AgCl,而Ag2CrO4的溶解度大于AgCl,故应选用K2CrO4溶液(或其他可溶性铬酸盐)做指示剂,当溶液中出现砖红色沉淀时,表明Cl-已沉淀完全。25.00mL样品溶液消耗标准AgNO3溶液的体积为20.00mL,根据Cl原子守恒可得,n(ClNO)= n(AgCl) = n(AgNO3)=20.0010-3L0.20molL-1=20.0010-3L0.20mol=4.0010-3mol,则3.0g样品中亚硝酰氯(ClNO)的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】以不同类别物质间的转化为线索,认识钠及其化合物。
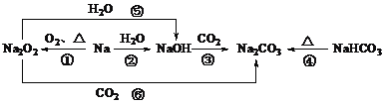
下列分析不正确的是
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明NaHCO3的稳定性强于Na2CO3
C.反应⑤、⑥可用于潜水艇中氧气的供给
D.上述转化中发生的反应有分解反应、化合反应、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁是常见的金属,其化合物也有广泛的用途。回答下列问题:
(1)氢氧化铝是一种两性氢氧化物,写出它的电离方程式___,将少量的稀盐酸逐渐滴入NaAlO2溶液,产生的现象为___,用平衡移动原理来解释这一现象:___。
(2)明矾可以用于净水,用离子反应方程式来解释原理:___,将Ba(OH)2溶液滴入明矾溶液中,当SO42-完全沉淀,则铝元素在溶液中存在的形式为___(用化学式表示)。
(3)高铁酸钠(Na2FeO4)可用作高效水处理剂,既可以杀菌消毒,又可以除去水中的悬浮颗粒物,请用你所学过的化学原理加以解释。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Na2O2与H2O反应:2O![]() +2H2O===O2↑+4OH-
+2H2O===O2↑+4OH-
B.向Fe2(SO4)3溶液中加入足量Cu粉:2Fe3++3Cu===2Fe+3Cu2+
C.向NaHSO4溶液中加入Ba(OH)2溶液至中性:2H++SO![]() +Ba2++2OH-===BaSO4↓+2H2O
+Ba2++2OH-===BaSO4↓+2H2O
D.向银氨溶液中加入足量盐酸:[Ag(NH3)2]++2H+===Ag++2NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g) = CO(g) ΔH=—110.5 kJ/mol;CO(g)+
O2(g) = CO(g) ΔH=—110.5 kJ/mol;CO(g)+![]() O2(g) = CO2(g) ΔH=—283 kJ/mol。与这些碳完全燃烧相比,损失的热量是 ( )
O2(g) = CO2(g) ΔH=—283 kJ/mol。与这些碳完全燃烧相比,损失的热量是 ( )
A.172.5 kJB.110.5 kJC.283 kJD.566 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃是重要的有机化合物.其中乙烯是最简单的一种烯烃,其产量代表着一个国家石油化工产业的水平。
完成下列问题:
(1)实验室用如图所示装置制取乙烯,反应方程式是____,无水乙醇与浓硫酸的体积比为1:3,请解释加入浓硫酸不宜过少的原因是__。

(2)反应需要迅速升温至所需温度的理由是___。所以烧瓶中应放入的固体物质是___,其作用是____。
(3)烯烃通过催化加氢可以得到烷烃。请写出一种可以通过催化加氢反应得到2,2-二甲基丁烷的结构简式:___。
(4)有一种烷烃A,分子式C9H20,它却不能由任何C9H18的烯烃催化加氢得到。请写出A的结构简式___,在A的同分异构体中,却存在只能由1种烯烃催化加氢得到的烷烃,请写出一种符合要求的A的同分异构体的结构简式:___。
烯烃还可以与卤素单质、卤化氢、水发生加成反应,产物有主次之分,例如:


(5)化学式为C4H8的某烃A与HBr加成得到的主要产物,其一氯代物只有一种,请写出A发生聚合反应的方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在1L的密闭容器中充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
CH3OH(g)+H2O(g)H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
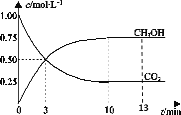
A.T℃时,平衡常数K=3,CO2与H2的平衡转化率相等
B.T℃时,上述条件下达到平衡时放出49.0kJ的热量
C.降温和缩小容器体积均可使反应的平衡常数增大
D.从反应开始到3min,H2的平均反应速率υ(H2)=0.5molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷和Cl2(g)反应的能量关系如图所示。下列叙述正确的是
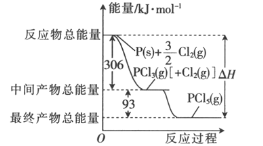
A.PCl5(g)比PCl3(g)稳定B.加入催化剂不会改变△H的大小
C.整个过程吸收的能量为399kJD.PCl3(g)的燃烧热△H=-93kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com