
【题目】铝、铁是常见的金属,其化合物也有广泛的用途。回答下列问题:
(1)氢氧化铝是一种两性氢氧化物,写出它的电离方程式___,将少量的稀盐酸逐渐滴入NaAlO2溶液,产生的现象为___,用平衡移动原理来解释这一现象:___。
(2)明矾可以用于净水,用离子反应方程式来解释原理:___,将Ba(OH)2溶液滴入明矾溶液中,当SO42-完全沉淀,则铝元素在溶液中存在的形式为___(用化学式表示)。
(3)高铁酸钠(Na2FeO4)可用作高效水处理剂,既可以杀菌消毒,又可以除去水中的悬浮颗粒物,请用你所学过的化学原理加以解释。___。
【答案】H2O+AlO2-+H+![]() Al(OH)3
Al(OH)3![]() Al3++3OH- 产生白色沉淀 加入稀盐酸后,H+会逐渐结合AlO2-,酸式解离平衡式会逐渐向着生成氢氧化铝的方向移动 KAl(SO)2=K++Al3++2SO42;Al3++3HO
Al3++3OH- 产生白色沉淀 加入稀盐酸后,H+会逐渐结合AlO2-,酸式解离平衡式会逐渐向着生成氢氧化铝的方向移动 KAl(SO)2=K++Al3++2SO42;Al3++3HO![]() Al(OH)3(胶体)+3H KAlO2 高铁酸盐(钠、钾)中铁元素为正六价,具有很强的氧化性,溶于水中能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒。同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物
Al(OH)3(胶体)+3H KAlO2 高铁酸盐(钠、钾)中铁元素为正六价,具有很强的氧化性,溶于水中能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒。同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物
【解析】
(1) 氢氧化铝是一种两性氢氧化物,即存在酸式电离和碱式电离,故其电离方程式H2O+AlO2-+H+![]() Al(OH)3
Al(OH)3![]() Al3++3OH- ,将少量的稀盐酸逐渐滴入NaAlO2溶液,产生的现象为白色沉淀,加入稀盐酸后,H+会逐渐结合AlO2-,酸式解离平衡式会逐渐向着生成氢氧化铝的方向移动;
Al3++3OH- ,将少量的稀盐酸逐渐滴入NaAlO2溶液,产生的现象为白色沉淀,加入稀盐酸后,H+会逐渐结合AlO2-,酸式解离平衡式会逐渐向着生成氢氧化铝的方向移动;
(2)明矾溶于水发生水解,铝离子水解生成氢氧化铝和硫酸,反应的离子方程式为Al3++3H2OAl(OH)3+3H+;设明矾为1mol,则溶液中含有1molAl3+,2molSO42-,由反应SO42-+Ba2+=BaSO4↓可知,使SO42-全部转化成BaSO4沉淀,需要2molBa(OH)2,则加入4molOH-,则发生Al3++4OH-=AlO2-+2H2O,所以最后溶液中存在AlO2-;
(3)高铁酸钠具有强氧化性,可用于杀菌消毒,还原生成Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,试回答:
Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,试回答:
(1)增加Fe的物质的量,其正反应速率___________。
(A.变快B.不变C变慢,填字母代号)。
(2)将容器的体积缩小一半,其正反应速率___________,逆反应速率___________。
(3)若保持体积不变,充入Ar,其逆反应速率___________。
(4)保持压强不变,充入Ar,其正反应速率___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是一种非常活泼、具有广泛应用的金属。
(1)钠的原子结构示意图为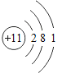 ,钠在反应中容易___电子(填“得到”或“失去”)。
,钠在反应中容易___电子(填“得到”或“失去”)。
(2)金属钠非常活泼,通常保存在________里,以隔绝空气。
(3)汽车安全气囊的气体发生剂NaN3可由金属钠生产。某汽车安全气囊内含NaN3、Fe2O3和NaHCO3等物质。
ⅰ.当汽车发生较严重的碰撞时,引发NaN3分解2NaN3 = 2Na + 3N2,从而为气囊充气。N2的电子式为_________。
ⅱ.产生的Na立即与Fe2O3发生置换反应生成Na2O,化学方程式是________。
ⅲ.NaHCO3是冷却剂,吸收产气过程释放的热量。NaHCO3起冷却作用时发生反应的化学方程式为________。
ⅳ.一个安全气囊通常装有50 g NaN3,其完全分解所释放的N2为_______mol。
(4)工业通过电解NaCl生产金属钠:2NaCl(熔融)![]() 2Na+Cl2,过程如下:
2Na+Cl2,过程如下:
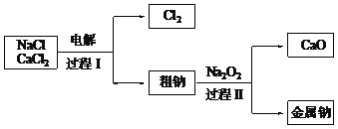
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入CaCl2从而把熔点降至约580℃。
①把NaCl固体加热至熔融状态,目的是________。
②电解时,要避免产生的Na与Cl2接触而重新生成NaCl。用电子式表示NaCl的形成过程________。
③粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是________。
④过程Ⅰ中,CaCl2能发生像NaCl那样的电解反应而被消耗。但在过程Ⅰ中CaCl2却不断地被重新生成,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素的原子半径的相对大小、最高正价或最低负价的变化如下图所示,下列分析正确的是( )
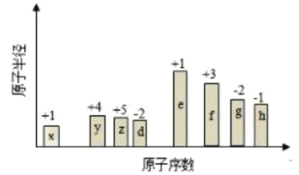
A.![]() 、
、![]() 的简单离子半径大小:
的简单离子半径大小:![]()
B.元素的金属性:![]()
C.元素的非金属性:![]()
D.![]() 、
、![]() 、
、![]() 和
和![]() 四种元素能形成离子化合物
四种元素能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种重要的有机合成原料,其球棍模型如图甲所示。该化合物可用芳香烃A为原料来合成,其合成路线如图乙所示:
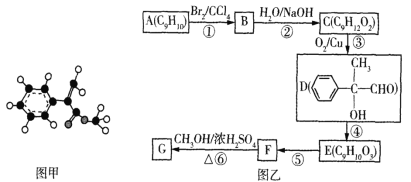
(1)下列关于G的说法不正确的是___(填标号)。
a.G的结构简式为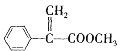
b.G能使酸性高锰酸钾溶液和溴水褪色,褪色原理相同
c.G的分子中所有碳原子可能处于同一平面内
d.G在一定条件下能发生水解、加成、加聚、氧化等反应
(2)F中的官能团名称为___,E的结构简式为___。
(3)反应①~⑥中属于取代反应的有___(填标号)。
(4)D的核磁共振氢谱的峰面积之比为____。
(5)写出D与银氨溶液反应的化学方程式:____。
(6)写出同时符合下列条件的F的同分异构体的结构简式:___(不考虑立体异构)。
a.分子内含苯环
b.苯环上只有一个支链
c.能发生银镜反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境、科学、技术密切相关。下列有关说法中正确的是( )
A.华为首款5G手机搭载了智能的7nm制程SoC麒麟980芯片,此芯片主要成分是二氧化硅
B.用于制作N95型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上无支链
C.国产飞机C919用到的氮化硅陶瓷是传统有机非金属材料
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是( )
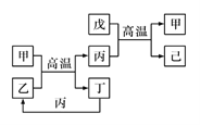
A.W的原子半径大于Z,金属性强于Z
B.W元素在周期表中的位置是第四周期VIIIB族
C.可以通过电解熔融的己来制备戊
D.X和Y形成的化合物中只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、

试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式___。
(2)装置B的作用是①__,②___。
(3)若用A装置制取NO气体,B中应该盛放__。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为__。
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与__同时通入NaOH溶液中。
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:__。(仅提供的试剂:1molL-1HCl、1molL-1HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20molL-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用___做指示剂。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:2SO2(g) +O2(g) ![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.4mol/L
B. SO2为 0.25mol/L
C. SO2、SO3均为0.15mol/L
D. SO3为0.4mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com