
【题目】核磁共振谱(NMR)是研究有机化合物结构的重要手段。在所研究的化合物分子中,等性氢原子在NMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中氢原子数成正比。如乙醛分子(CH3CHO)的NMR谱中有2个峰,其强度比是3∶1。乙醇分子(CH3CH2OH)的NMR谱中有3个峰,其强度比是 3∶2∶1。
(1)苯的NMR谱中应该有________个峰;甲苯的NMR谱中有_______个峰。
(2)某化合物C3H6O2的NMR谱中有3个峰,其强度比为3∶2∶1,则该化合物的结构简式可能为______。
(3)研究发现,结构简式为CH3CH![]() CHCl的化合物的NMR谱中有6个峰,原因是_____。
CHCl的化合物的NMR谱中有6个峰,原因是_____。
【答案】1 4 CH3CH2COOH(或HCOOCH2CH3、CH3OCH2CHO) 碳碳双键为平面结构,故CH3CH![]() CHCl实际上有2种结构不同的分子,即
CHCl实际上有2种结构不同的分子,即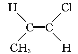 和
和 ,两种分子中各有3种化学环境不同的氢原子,故共有6个峰。
,两种分子中各有3种化学环境不同的氢原子,故共有6个峰。
【解析】
(1)苯分子为平面正六边形,结构对称;甲苯分子只有1条对称轴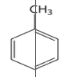 ;
;
(2)化合物C3H6O2的NMR谱中有3个峰,其强度比为3∶2∶1,则含有3种等效氢;
(2)化合物CH3CH![]() CHCl存在顺反异构。
CHCl存在顺反异构。
(1)苯分子为平面正六边形,结构对称,所以只有1种H原子,NMR谱中应该有1个峰;甲苯分子中有1个对称轴、4种不同环境的氢原子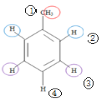 ,NMR谱中应该有4个峰;
,NMR谱中应该有4个峰;
(2)化合物C3H6O2的NMR谱中有3个峰,含有3种等效氢,其强度比为3∶2∶1,则C3H6O2的结构简式是CH3CH2COOH(或HCOOCH2CH3、CH3OCH2CHO);
(3)碳碳双键为平面结构,故CH3CH![]() CHCl实际上有2种结构不同的分子,即
CHCl实际上有2种结构不同的分子,即 和
和 ,两种分子中各有3种化学环境不同的氢原子,故共有6个峰。
,两种分子中各有3种化学环境不同的氢原子,故共有6个峰。


科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是
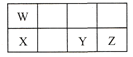
A.原子半径大小:X > Y > Z
B.W、Y两种元素都能与氧元素形成化合物WO2、YO2
C.氧化物对应水化物的酸性: Z > Y > W
D.Y能形成H2Y、H2YO4的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸乙酯是白酒的香气成分之一,广泛用于食品香精。适量添加可增加白酒中酯的浓度,增加白酒的香气,是清香型白酒的主体香成份。乳酸乙酯发生如图变化(已知烃A是衡量一个国家石油化工发展的重要标志)
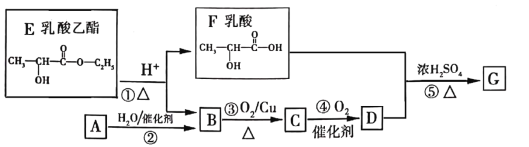
(1)A分子的空间构型是_______。
(2)D的化学式是_______________,F中含氧官能团的名称是______________。
(3)②的化学方程式是___________,⑤的反应类型是_________
(4)1mol乳酸与足量NaOH反应,消耗NaOH__________mol。
(5)绿色化学的核心内容之一是“原子经济性”,即原子的理论利用率为100%。下列转化符号绿色化学要求的是__________(填序号)。
a.乙醇制取乙醛 b.甲烷制备CH3Cl c.2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500~600℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。

(1)写出仪器的名称:a_______________,b___________________。
(2)A中反应的化学方程式为____________。
(3)装置B中加入的试剂是_____________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置______和 ________(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是___________________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用如图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
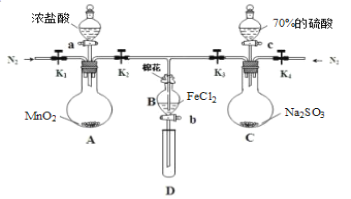
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_____________。
(2)棉花中浸润的溶液为________________,作用是____________ 。
(3)导致步骤Ⅲ中溶液变黄的离子反应是__________,用________(写试剂化学式)检验氧化产物,现象是____________。
(4)能说明氧化性Fe3+>SO2的离子方程式是___________。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有 |
乙 | 既有Fe3+又有Fe2+ | 有 |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A.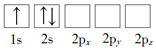 B.
B.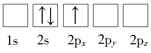
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
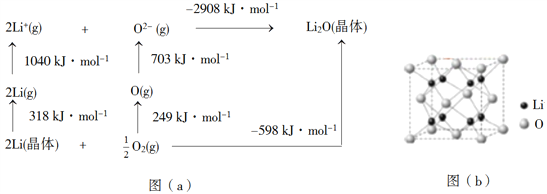
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为只含有C、H、O三种元素的芳香烃衍生物,且苯环上只有两个取代基。各物质间的相互转化关系如下图所示。

已知:D通过加聚反应得到 E,E分子式为(C9H8O2)n;H分子式为C18H16O6;I中除含有一个苯环外还含有一个六元环。
(1)写出A的分子式:A______________。
(2)写出I、E的结构简式:I______________ E_________________;
(3)A+G→H的反应类型为____________________________;
(4)写出A→F的化学方程式__________________________。
(5)有机物A的同分异构体只有两个对位取代基,既能与Fe3+发生显色反应,又能发生水解反应,但不能发生银镜反应。则此类A的同分异构体有_______种,其中一种在NaOH溶液中加热消耗的NaOH最多。写出该同分异构体与NaOH溶液加热反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是人体必需的微量元素,右图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种化合物的溶解度随温度变化曲线如图所示,下列说法正确的是( )
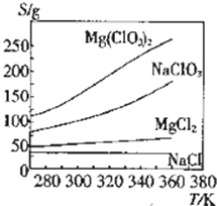
A.NaClO3的溶解是放热过程
B.由图中数据可求出300K时MgCl2饱和溶液的物质的量浓度
C.可采用复分解反应制备Mg(ClO3)2:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl
D.若NaCl中含有少量Mg(ClO3)2,可用降温结晶方法提纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com