
【题目】下列叙述正确的是( )
A.一个CsCl晶胞中含有8个Cl-。
B.离子晶体类的物质均是电解质,故离子晶体均能导电。
C.锗和碳都存在具有原子晶体结构的单质,锗和碳都易形成四个键,能形成原子晶体结构。
D.某物质是由X(黑球)、Y(白球)两种微粒构成的,它们在二维平面中的排列情况为![]() ,则该物质化学式为XY2。
,则该物质化学式为XY2。
【答案】C
【解析】
A.一个CsCl晶胞中,Cs+在体心、个数为1,Cl-在顶角上,要和旁边的正方体均摊,含有8×1/8=1,则一个CsCl晶胞中含有1个Cl-,A错误;
B.离子晶体类的物质均是电解质,离子晶体内的离子不能自由移动,均不能导电,B错误;
C.锗和碳都是第IVA族的元素,存在具有原子晶体结构的单质,锗和碳都易形成四个键,能形成原子晶体结构,C正确;
D.某物质是由X(黑球)、Y(白球)两种微粒构成的,分析其在二维平面中的排列情况,可以发现每个黑球与6个白球紧密接触,而1个白球只与2个黑球紧密接触,黑球与白球的个数比为1:3,故该物质化学式为XY3,D错误;
答案为C;


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4LCCl4中含原子总数为5NA
B.物质的量浓度为0.5![]() MgCl2溶液中,含有Cl—数目为NA
MgCl2溶液中,含有Cl—数目为NA
C.常温常压下,NA个CO2分子占的体积大于22.4L
D.3.2g由氧气和臭氧组成的混合物中含有氧气分子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
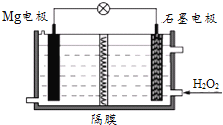
A.Mg电极是该电池的正极
B.溶液中的Cl-向正极移动
C.H2O2在石墨电极上发生氧化反应
D.石墨电极附近溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取9.28g Na2CO3·x H2O溶于水配成5mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸20mL,并收集到896mL CO2(标准状况下)。求:
(1)稀盐酸的物质的量浓度;________
(2)x的值。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸HX是一元弱酸,25℃时的电离平衡常数K a= 4.0×10—8。
(1)写出该酸的电离方程式_____________,其电离平衡常数表达式K a =_______。
(2)25℃时,向1 mol·L-1 HX 溶液中加入1 mol·L-1 盐酸,会________(“抑制”或“促进”)HX的电离,c(H+)____________(填“增大”、“减小”或“不变”), 电离平衡常数K a ________(填“增大”、“减小”或“不变”)。
(3)25℃时,若HX的起始浓度为0.01 mol·L-1,则平衡时c(H+)=_________mol/L, 由水电离的出的c(H+)=___________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2)基态K原子中,核外电子排布图是_________,占据最高能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是______________________________________。
(3)测定发现I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化类型为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。

(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是典型的可充电电池,电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。回答下列问题:
2PbSO4+2H2O。回答下列问题:
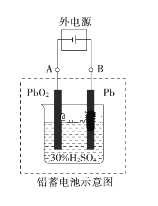
(1)放电时,负极为_______电极,试写出该电极的电极反应式是___________。电解液中H2SO4的浓度将变____________。(填“升高”、 “降低” 或“不变”)
(2)电池放电时,当外电路通过0.1 mol电子时,理论上负极板的质量增加________g,电池中消耗的硫酸物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
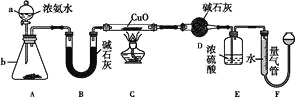
(1)仪器a的名称为____,仪器b中可选择的试剂为____。
(2)实验室中,利用装置A,还可制取的无色气体是____(填字母)。
A.Cl2 | B.O2 | C.CO2 | D.NO2 |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明NH3具有____性,写出相应的化学方程式:_______________________。
(4)E装置中浓硫酸的作用是_____________________________________。
(5)读取气体体积前,应对装置F进行的操作:____________________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 molL-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、____________。
②下列操作对实验结果的影响偏高的是____________(填序号)。
a.加水定容时俯视刻度线
b.未洗涤溶解后的烧杯和玻璃棒
c.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和_____________。
(3)维生素C的水溶液能使高锰酸钾溶液褪色,根据这一原理,常用高锰酸钾测定蔬菜或水果中的维生素C的含量。上述实验原理体现了维生素C具有_________。(填氧化性、还原性)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com