
【题目】下列关于电化学的说法中错误的是( )
A.原电池的负极、电解池的阳极均发生氧化反应
B.原电池将化学能转化为电能,电解池将电能转化为化学能
C.利用原电池原理可制备化学电源,利用电解池原理可制备化学物质
D.电解水制取H2和O2时,为了增强导电性,可加入NaCl、H2SO4
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】过碳酸钠(2 Na2CO3·3 H2O2)广泛用于化工、造纸、纺织、食品等行业,一种以芒硝(Na2SO4·10 H2 O)、H2O2等为原料制备过碳酸钠的工艺流程如下:
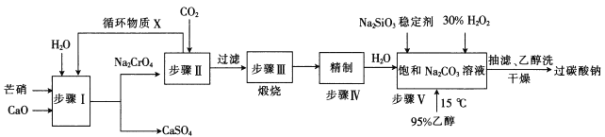
已知2CrO42-+2H+=Cr2O72-+H2O , pH小于5时几乎均以Cr2O72-形式存在,pH大于8.5时几乎均以CrO42-形式存在。
回答下列问题:
(1)Na2CrO4中Cr元素的化合价为___
(2)Ksp(CaCrO4)___(填“>”或“<”)Ksp(CaSO4)。
(3)流程中循环物质X为___(填化学式)。
(4)步骤II中发生反应的化学方程式为_________
(5)步骤I一III是为了制得纯碱,从环境保护的角度看,可能的不足之处是___
(6)步骤V合成时,加入95%的乙醇的目的是___
(7)测定产品活性氧的实验步骤如下:准确称取mg产品,用硫酸溶解后,用c mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V mL。
①滴定到终点时,溶液呈___(填“无色”或“浅红色”)。
②过氧化物的活性氧是指过氧化物单独用催化剂催化分解时放出氧气的质量与样品的质量之比。该实验测得的产品中活性氧为___(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子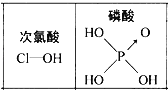
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
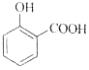 +2HCO3-→
+2HCO3-→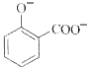 +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用SiHCl3在加热条件下与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):
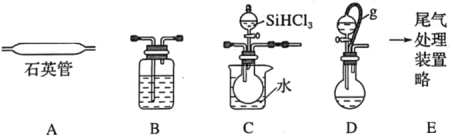
已知:SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃;
请问答:
(1)依次连接的合理顺序为__。
(2)操作时应先打开装置__(选填“C”或“D”)中分液漏斗的旋塞,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是

A. 0-t1时,正极的电极反应式为:2H++ NO3- - e-=NO2+ H2O
B. 0-t1时,溶液中的H+ 向Cu电极移动
C. t1时,负极的电极反应式为:Cu–2e-= Cu2+
D. t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
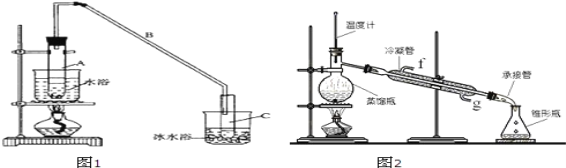
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇为主要原料制备环己烯。
已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 熔点(℃) | |
环乙醇 | 0.96 | 25 | 161 | 难溶于水 |
环乙烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____。
②试管C置于冰水浴中的目的是_____。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层。(填上或下)
②再将环己烯按图2装置蒸馏,冷却水从口进入_____(填“g”或“f”)。收集产品时,控制的温度应在_____左右,实验制得的环己烯精品质量低于理论产量,最可能的原因是_____。
A.蒸馏时从70℃开始收集产品
B.环已醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中的总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),计算△H=___。反应原料来自煤的气化。已知该反应的平衡常数表达式为K=
CH3OCH3(g)+CO2(g),计算△H=___。反应原料来自煤的气化。已知该反应的平衡常数表达式为K=![]() ,每生成1molH2需要吸收131.3kJ的热量。写出该反应的热化学方程式___。
,每生成1molH2需要吸收131.3kJ的热量。写出该反应的热化学方程式___。
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L-1,c(H2)=1.4mol·L-1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为___。
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L-1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)
CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)

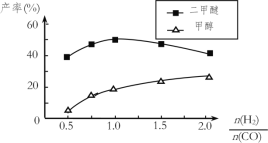
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:__。
的改变二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com