
【题目】用SiHCl3在加热条件下与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):
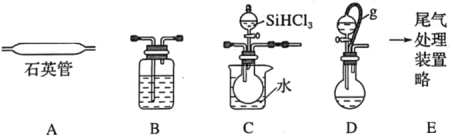
已知:SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃;
请问答:
(1)依次连接的合理顺序为__。
(2)操作时应先打开装置__(选填“C”或“D”)中分液漏斗的旋塞,理由是__。
【答案】DBCAE或DBCABE D SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气
【解析】
A装置主要是SiHCl3与过量H2在加热条件下反应制备纯硅,B主要是干燥气体,C主要是将SiHCl3转变为气体在A中反应,D是氢气发生装置,E尾气处理装置。
⑴先是氢气发生装置,再是干燥装置,再是将汽化装置,再是反应装置,再是尾气处理装置,也可以先干燥后再处理尾气,因此依次连接的合理顺序为DBCAE或DBCABE;故答案为:DBCAE或DBCABE。
⑵由于SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃,整个装置需要先排除装置内空气,因此操作时应先打开装置D中分液漏斗的旋塞,理由是SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气;故答案为:D;SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
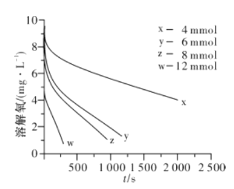
【题目】I.亚硫酸钠的氧化反应:2Na2SO3 (aq) +O2(aq)=2Na2SO4(aq) H=x kJ/mol。其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。
(1)已知O2(g) ![]() O2(aq) H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
O2(aq) H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
(2)291.5 K时,1.0 L溶液中Na2SO3初始量分别为4、6、8、12 mmol,溶解氧浓度初始值为9.60 mg/L,每5 s记录溶解氧浓度,实验结果如图所示。当Na2SO3初始量为12 mmol,经过20 s溶解氧浓度降为6.40 mg/L,则0~20s内Na2SO3的平均反应速率为_______mol/(L·s)。
(3)为确定贫氧区速率方程v=k·ca(SO32-)·cb(O2)中的a、b的值(取整数),分析实验数据。
c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0 mg/L时,c(SO32-)与速率数值关系如表(甲)所示,则a=____。
②当溶解氧浓度小于4.0mg/L时,图中曲线皆为直线,Na2SO3氧化速率与溶解氧浓度无关,则b=_______。
(4)两个阶段不同温度的速率常数之比如表(乙)所示。已知![]() ,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 |
|
富氧区 | v=k·c (SO32-)·c (O2) | 1.47 |
贫氧区 | v=k·ca (SO32-)·cb(O2) | 2.59 |
II. (5)在容积固定的密闭容器中,起始充入0.2 mol SO2和0.1 mol O2,反应体系起始总压强0.1MPa。反应在一定温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=________ ( 分压=总压×物质的量分数)(写单位)。
(6)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极反应式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.乙烯分子中的 σ键和π键比例为 5:1
B.某元素气态基态原子的逐级电离能(kJmol﹣1)分别为 738、1451、7733、10540、13630、17995、21703, 当它与氯气反应时可能生成的阳离子是 X2+
C.Na、P、Cl 的电负性依次增大
D.向配合物[TiCl(H2O)5]Cl2H2O 溶液中加入足量的 AgNO3 溶液,所有 Cl-均被完全沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是( )

A.分子中含有4种含氧官能团
B.分枝酸一定条件下可以发生缩聚反应们不能发生加聚反应
C.1mol分枝酸最多可与2molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中进行可逆反应2NO2(g)![]() 2NO(g)+O2(g),下列可以作为反应达到化学平衡状态标志的有( )
2NO(g)+O2(g),下列可以作为反应达到化学平衡状态标志的有( )
A.单位时间内生成nmolO2的同时生成2nmolNO
B.NO2、NO、O2的物质的量之比为2:2:1的状态
C.密闭容器中压强不再改变的状态
D.密闭容器中气体的密度不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电化学的说法中错误的是( )
A.原电池的负极、电解池的阳极均发生氧化反应
B.原电池将化学能转化为电能,电解池将电能转化为化学能
C.利用原电池原理可制备化学电源,利用电解池原理可制备化学物质
D.电解水制取H2和O2时,为了增强导电性,可加入NaCl、H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是( )
A.向0.1mol/LNH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)c(NH4+)c(SO42-)c(OH-)c(H+)
B.0.1mol/LNaHC2O4溶液呈酸性:c(Na+)c(HC2O4-)c(H2C2O4)c(C2O42-)
C.20mL0.1mol/LCH3COONa溶液与10mL0.1mol/LHCl溶液混合后的酸性溶液:cCH3COOH2cH+c(CH3COO-)cOH-
D.浓度均为0.1mol/L的小苏打溶液与烧碱溶液等体积混合:c(Na+)c(H+)2c(CO32-)c(OH-)c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关烃类物质的说法正确的是( )
A. 石油通过减压分馏可以得到相对分子量较大的芳香烃
B. 丙烯与溴的四氯化碳溶液反应生成1,3-二溴丙烷
C. ![]() 中至少有16个原子共平面
中至少有16个原子共平面
D. ![]() 的一氯代物的同分异构体有12种
的一氯代物的同分异构体有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)可用于制造高能电池元件。电解法制备过程如下:用NaOH 溶液将NiCl2溶液的pH调至7.5(该pH下溶液中的Ni2+不沉淀),加入适量硫酸钠固体后进行电解。电解过程中产生的Cl2(不考虑Cl2的逸出)在弱碱性条件下生成ClO﹣,ClO﹣再把二价镍(可简单写成Ni2+)氧化为Ni3+,再将Ni3+经一系列反应后转化为Ni2O3,电解装置如图所示。下列说法不正确的是( )

A. 加入适量硫酸钠的作用是增加离子浓度,增强溶液的导电能力
B. 电解过程中阴、阳两极附近溶液的pH均升高
C. 当有1mol Ni2+氧化为Ni3+时,外电路中通过的电子数目为1NA,通过阳离子交换膜的Na+数目为1NA
D. 反应前后b池中Cl- 浓度几乎不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com