
【题目】选择装置,完成实验。

(1)用饱和食盐水除去氯气中的氯化氢,应选用______(填序号,下同)。
(2)除去食盐水中的泥沙,应选用______。
(3)用自来水制取蒸馏水,应选用______。
(4)用四氯化碳提取碘水中的碘,应选用______。
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:
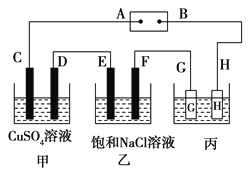
(1)电极A是__________________(填“正极”或“负极”)。
(2)甲装置中电解反应的总化学方程式是_______________。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH=__________________。
(4)欲用丙装置给铜镀银。G应该是___(填“银”或“铜”),电镀液的主要成分是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24LH2O中含有共价数目为2NA
B. NA个氧气分子与NA个氢分子的质量比为8:1
C. 8gCuO与足量H2充分反生成Cu,该反应转移的电子数为0.2NA
D. 4.6g金属钠与500mL 0.2mol/L的盐酸充分反应,转移电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是

A. 大理石和稀盐酸
B. NaOH和NH4Cl
C. Cu和浓硝酸
D. MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置及药品制取氨气。

(1)A中制氨气的化学方程式是______。
(2)B中碱石灰的作用是______。
(3)C处是用集气瓶收集氨气的装置,请绘出装置图。______
(4)证明氨气已集满的操作和现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol I2(g) 和2 mol H2置于2L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示,则:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示,则:
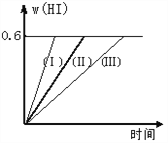
(1)达平衡时,I2(g)的物质的量浓度为___________ 。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是___________,则乙条件可能是___________ 。(填入下列条件的序号)
①恒容条件下,升高温度; ②恒容条件下,降低温度;
③恒温条件下,缩小反应容器体积;
④恒温条件下,扩大反应容器体积;
⑤恒温恒容条件下,加入适当催化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:

则:(1)① 不用通入O2氧化的方法除去CO的原因是 ______________________________。
②SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示:
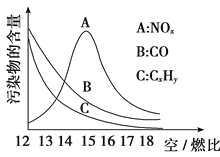
①随空/燃比增大,CO和CxHy的含量减少的原因是_____________________________。
②当空/燃比达到15后,NOx减少的原因可能是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)A中的化学方程式为_______________________________________。
(2)通入足量SO2时C中观察到的现象为________________________________。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子_________________________________。
②请设计实验方案检验有Fe2+生成__________________________________。
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_______(填“合理”或“不合理”),理由是___________。
(4)D装置中倒置漏斗的作用是__________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________。
a.浓硫酸 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com