
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol??L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| A、1mol羧基中含有的电子数为23NA |
| B、精炼铜过程中阴极增重6.4g时,电路中转移电子数大于0.2NA |
| C、1mol OH-中含有的电子数为为9NA |
| D、标准状况下,22.4L苯含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氧族元素的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含氧族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
氧族元素的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含氧族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 装置 | 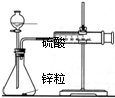 | 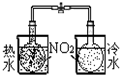 | 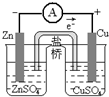 |  |
| 实验 | 结合秒表测量锌与硫酸的反应速率 | 验证温度对化学平衡的影响 | 验证化学能转化为电能 | 铁的析氢腐蚀实验 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com