
【题目】(1)对于反应2S02(g)+O2(g)=2SO3(g),当其他条件不变时,只改变一个反应条件。将生成SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3的速率 |
① | 降低温度 | |
② | 压缩体积 | |
③ | 使用催化剂 |
(2)用铜片、锌片和稀硫酸及若干其他器材组合成一个原电池.如图所示。回答下列问题:

① 该原电池装置将_______(选填“化学能转化为电能”或“电能转化为化学能”);
② 此电池的负极是______,正极的电极反应方程式是________。
③ 该电池工作一段时间,将两个电极小心取出洗涤并晾干,经称量发现锌片比原来减少6.5g(锌的相对原子质量为:65)。请计算理论上导线中共通过了____mol电子。
【答案】(1)①减小;②增大;③增大;(2)①化学能转化为电能;②锌;2H++2e-=H2↑;③0.2。
【解析】
试题分析:(1)①降低温度,化学反应速率减小;②压缩体积,可以使物质的浓度增大,所以很想反应速率增大;③使用催化剂可以降低反应的活化能,从而使化学反应速率增大;(2)①由于该装置具有原电池的构成条件,所以可以形成原电池,该原电池装置将化学能转化为电能的装置;②由于金属活动性Zn>Cu,所以此电池的负极是锌。正极是铜;正极上溶液的氢离子获得电子,发生还原反应,电极反应式是2H++2e-=H2↑;③电池工作一时间后,经称量发现锌片比原来减少6.5g,反应的锌的物质的量是n(Zn)=6.5g÷65g/mol=0.1mol,由于Zn是+2价的金属,所以反应过程中理论上导线中共通过电子的物质的量是n(e-)=2n(Zn)=2×0.1mol=0.2mol。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】(1)基态Cu2+的核外电子排布式为 ,在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。根据元素原子的外围电子排布特征,可将周期表分成五个区域,元素Cu属于 区。
(2)下列叙述不正确的是 。(填字母)
a.HCHO和CO2分子中的中心原子均采用sp杂化
b.因为HCHO与水分子间能形成氢键,所以HCHO易溶于水
c.C6H6分子中含有6个σ键和1个大π键,C2H2是非极性分子
d.CO2晶体的熔点、沸点都比二氧化硅晶体的低,原因是CO2为分子晶体而二氧化硅是原子晶体
(3)氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。其中的C的杂化类型为 ,写出一种与 CN— 互为等电子体的单质分子式 。
(4)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
② 六氰合亚铁离子[Fe(CN)6]4 -中不存在 。
a.共价键
b.非极性键
c.配位键
d.σ键
e.π键
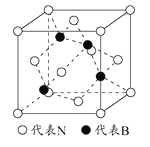
(5)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其晶胞结构与金刚石类似,一个该晶胞中含有 个氮原子, 个硼原子,设氮原子半径为a pm,硼的原子半径b pm ,求该晶胞的空间利用率 。(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中的杂质(括号内的物质)除去时,所使用的试剂和主要操作都正确的是( )
选项 | 物质 | 使用的试剂 | 主要操作 |
A | 乙醇(水) | 金属钠 | 过滤 |
B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
C | 苯(苯酚) | 浓溴水 | 振荡、分液 |
D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中部分元素,请回答下列问题:
IA | IIA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
1 | H | He | ||||||
2 | Li | C | N | O | F | |||
3 | Na | Al | Si | S | Cl |
(1)上表所列元素中,属于金属元素的有_____种,金属性最强的元素与氧反应生成的化合物有Na2O和________(填化学式)。
(2)上表所列元素中,化学性质最不活泼的是_____,非金属性最强的元素形成的单质的电子式为__________。
(3)N、C、Si三种元素的气态氢化物中,最稳定的是______(化学式)。
(4)上表所列的第三周期的元素中,原子半径最小的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素(H2NCONH2)是一种农业生产中常用的氮肥。在工业上,尿素还用于制造有机铁肥,如[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)]。回答下列问题:
(1)基态Fe3+的核外价电子排布式为 。
(2)C、N、O三种元素的第一电离能由大到小的顺序是 。
(3)在一定条件下,NH3与CO2能合成尿素,1mol尿素分子中,σ键的数目为 ;尿素分子中C原子的杂化方式为 。
(4)NO3-的空间构型为 ;写出NO3-互为等电子体的一种分子的化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ⅰ.质谱分析测得有机化合物A的相对分子质量为92.5,含有碳、氢、氯三种元素,且氢的质量分数为9.73%。
Ⅱ.A有如下的转化关系

Ⅲ.与羟基相连的碳上没有氢原子的醇(结构: )不能氧化成醛或酮。
)不能氧化成醛或酮。
Ⅳ.F的核磁共振氢谱有两种吸收峰,其峰面积之比为9∶1。
Ⅴ.E和G都能和新制的Cu(OH)2悬浊液反应,但反应类型不同,H是一种具有果香味的液体。
根据以上信息回答下列问题
(1)A的结构简式为______________________。
(2)反应⑦的反应类型为_____________________。
(3)D还有两种相同类别的同分异构体在Ⅱ中没有出现,它们的名称分别为______________________________________和______________________________________。
(4)在B的同分异构体中存在顺反异构现象,请写出其反式异构体的结构简式:___________。
(5)写出下列反应的化学方程式:
E与新制的Cu(OH)2悬浊液反应_____________________________________________。
反应⑧_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①乙醇与氧气在铜催化下反应;②淀粉在稀硫酸作用下在水中加热;③葡萄糖与钠反应;④乙醇一定条件下与乙酸反应中,不包括的反应类型是
A.氧化反应 B.加成反应 C.酯化反应 D.水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com