
【题目】Cr3+基态核外电子排布式为_________________________________________________。
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是

A. 生铁片中所含的碳能增强铁的抗腐蚀性
B. 雨水酸性较强,生铁片开始发生析氢腐蚀
C. 导管内墨水液面回升时,正极反应式:O2+2H2O+4e—==4OH-
D. 随着反应的进行,U型管中雨水的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A.该反应的焓变△H>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一真空容器中,充入10 mol N2,30 mol H2,发生反应N2(g)+3H2(g)![]() 2NH3(g),在一定条件下达到平衡时,N2的转化率为25%。若在同一容器中,在相同温度下,向容器中充入NH3,欲使达到平衡时各成分的质量分数与上述平衡相同,则起始时NH3的量和达到平衡时NH3的转化率为
2NH3(g),在一定条件下达到平衡时,N2的转化率为25%。若在同一容器中,在相同温度下,向容器中充入NH3,欲使达到平衡时各成分的质量分数与上述平衡相同,则起始时NH3的量和达到平衡时NH3的转化率为
A. 20 mol、25% B. 20 mol、75% C. 40 mol、30% D. 10mol、50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
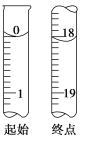
为测定产品纯度,进行了如下实验:准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为:
2S2O![]() +I2=S4O
+I2=S4O![]() +2I-
+2I-
①滴定至终点时,溶液颜色的变化:_____________________________。
②测定起始和终点的液面位置如图,则消耗碘的标准溶液体积为________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)__________________ ______________。
(2)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为______________,滴定反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,反应2SO2(g)+O2(g)![]() 2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积
2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积![]() (SO3)随温度变化的曲线应为 ( )
(SO3)随温度变化的曲线应为 ( )
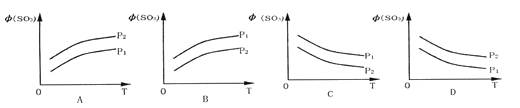
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,可大量共存的离子是( )
A.K+ Na+ OH﹣ SO42﹣
B.Mg2+ SO42﹣ NH4+ Cl﹣
C.K+ Na+ HCO3﹣ Cl﹣
D.K+ Na+ NO3﹣ CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为
A.2A+3B=2C B.A+3B=C C.3A+B=2C D.A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论预测H2S和BF3的空间构型,下列结论中正确的是( )
A. 直线形;三角锥形 B. V形;三角锥形
C. 正四面体;正四面体 D. V形;平面三角形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com