
【题目】常温下,分别取未知浓度的AOH和BOH两种碱的稀溶液,加水稀释至原体积的n倍。两溶液稀释倍数的对数值(lgn)与溶液的pH变化关系如图所示。下列叙述正确的是
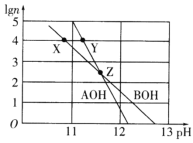
A.水的电离程度:Z>X=Y
B.常温下,Kb(BOH)<Kb(AOH)
C.中和等体积X、Y两点溶液,后者消耗HC1的物质的量多
D.物质的量浓度相同的AC1溶液和BC1溶液,前者阳离子浓度之和小于后者
【答案】CD
【解析】
A.碱溶液中H+全部来自水的电离,碱溶液的pH越大,水的电离程度越小,根据图像pH:Z>Y>X,则水的电离程度:Z<Y<X,故A错误;
B.根据图像,稀释相同倍数时BOH溶液pH的改变值大于AOH溶液pH的改变值,说明BOH的碱性大于AOH,则常温下电离平衡常数:Kb(BOH)>Kb(AOH),故B错误;
C.根据图像,稀释相同倍数时BOH溶液pH的改变值大于AOH溶液pH的改变值,说明BOH的碱性大于AOH,X、Y两点溶液稀释的倍数相同,Y点的pH大于X点,故Y点对应的AOH物质的量浓度较大,中和等体积X、Y两点溶液,Y消耗HC1的物质的量较多,故C正确;
D.根据图像,稀释相同倍数时BOH溶液pH的改变值大于AOH溶液pH的改变值,说明BOH的碱性大于AOH,物质的量浓度相同的AC1和BC1,氯离子浓度相等,由于A+的水解程度大于B+,则ACl溶液中c(H+)大于BCl溶液中c(H+),ACl溶液中c(OH-)小于BCl溶液中c(OH-),结合AC1和BC1溶液中存在的电荷守恒:c(A+)+c(H+)=c(OH)+c(C1),c(B+)+c(H+)=c(OH)+c(C1),ACl溶液中阳离子浓度之和小于BCl溶液中阳离子浓度之和,故D正确;
答案选CD。


科目:高中化学 来源: 题型:
【题目】已知一定温度时:2SO2(g)+O2(g)![]() 2SO3(g),当生成2mol SO3时,放出热量197kJ,在相同温度和压强下,向密闭容器中通入2mol SO2和1molO2,达到平衡时放出热量Q,则下列关系式中正确的是
2SO3(g),当生成2mol SO3时,放出热量197kJ,在相同温度和压强下,向密闭容器中通入2mol SO2和1molO2,达到平衡时放出热量Q,则下列关系式中正确的是
A.Q=197 kJ B.Q<197×2 kJ C.Q<197 kJ D.Q>197 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有KMnO4溶液的试管中加入过量的MnSO4溶液,产生黑色沉淀,溶液由紫红色变为无色;过滤,向滤液中加入少量的铋酸钠(NaBiO3)粉末,溶液又变为紫红色。下列推断错误的是
A.氧化性:NaBiO3>KMnO4>MnO2
B.生成8.7g黑色沉淀,转移0.2mol电子
C.利用NaBiO3可以检验溶液中的Mn2+
D.NaBiO3可与浓盐酸发生反应:NaBiO3+6HC1=BiCl3+Cl2↑+NaCl+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒的空间构型相同的共有几个( )
①NH3和H2O ②BF3和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥![]() 和
和![]() ⑦NF3和Al2Cl6
⑦NF3和Al2Cl6
A.6B.5C.4D.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。某高能锂离子电池的反应方程式为![]() (x<1)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸的装置如图所示(苯甲酸盐溶液酸化后可以析出苯甲酸)。下列说法正确的是
(x<1)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸的装置如图所示(苯甲酸盐溶液酸化后可以析出苯甲酸)。下列说法正确的是
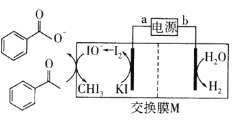
A.电池放电时,Li+向b极移动
B.电池充电时,a极反应式为LiCoO2-xe-=Lil-xCoO2+xLi+
C.M为阳离子交换膜
D.生成苯甲酸盐的反应为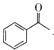 +3IO→
+3IO→![]() + CHI3+2OH-
+ CHI3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是指以锂离子嵌入化合物为正极材料的电池。研究锂离子电池的电极材料、电解液具有重要的现实意义。
(1)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
①Li+能量最低的激发态的电子排布图为______________________。
②第四电离能I4(Co)比I4(Fe)小,原因是______________________。
(2)锂离子电池的电解液有LiBF4等,碳酸亚乙酯(![]() )用作该电解液的添加剂。
)用作该电解液的添加剂。
①LiBF4中阴离子的空间构型为____________________。
②碳酸亚乙酯分子中碳原子的杂化方式为___________________;碳酸亚乙酯能溶于水的原因是______________________________________________________。
(3)硫化锂是目前正在研发的锂离子电池的新型固体电解质,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
硫离子:(0,0,0);(![]() ),
),![]() ;
;![]() ;……
;……
锂离子:![]() ;
;![]() ;
;![]() ;
;![]() ;……
;……
①在图上画出硫化锂晶胞沿x轴投影的俯视图。___________
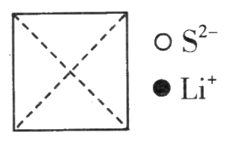
②硫离子的配位数为__________________。
③设NA为阿伏加德罗常数的值,硫化锂的晶体密度为________g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
A. 单位时间内生成n mol O2 的同时,生成2n molNO2 B. 混合气体的平均相对分子质量不再改变
C. 混合气体的颜色不再改变 D. NO2, NO, O2的速率之比是2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】王浆酸是从蜂王浆中分离出的一种有机酸,它有很好的杀菌、抗癌、抗放射及强化机体、增强免疫力的作用,其结构如下所示。有关王浆酸的说法不正确的是( )
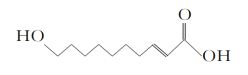
A. 分子式为C10H18O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下能发生取代反应和氧化反应
D. 1 mol王浆酸最多能中和2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com