
【题目】2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。某高能锂离子电池的反应方程式为![]() (x<1)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸的装置如图所示(苯甲酸盐溶液酸化后可以析出苯甲酸)。下列说法正确的是
(x<1)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸的装置如图所示(苯甲酸盐溶液酸化后可以析出苯甲酸)。下列说法正确的是
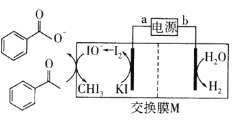
A.电池放电时,Li+向b极移动
B.电池充电时,a极反应式为LiCoO2-xe-=Lil-xCoO2+xLi+
C.M为阳离子交换膜
D.生成苯甲酸盐的反应为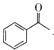 +3IO→
+3IO→![]() + CHI3+2OH-
+ CHI3+2OH-
【答案】BD
【解析】
根据锂离子电池的反应方程式为Li1一xCoO2+Lix C6![]() LiCoO2+C6 (x<1)可知,放电时LixC6发生失去电子的氧化反应,LixC6所在电极为负极,电极反应式为LixC6-xe-=xLi++C6,则Li1一xCoO2所在电极为正极,电极反应式为xLi++xe-+L1-x CoO2═LiCoO2;根据电解池中物质转化:H2O→H2可知,电解池右侧为阴极,电极反应式为2H2O+2e-=2OH-+H2↑,与原电池的负极相接,即b电极为原电池的负极、a电极为原电池的正极,电解池的左侧为电解池的阳极,发生失去电子的氧化反应,电极反应式为2I--2e-=I2,I2发生歧化反应生成IO-,离子方程式为I2+2OH-=I-+IO-+H2O,据此分析解答。
LiCoO2+C6 (x<1)可知,放电时LixC6发生失去电子的氧化反应,LixC6所在电极为负极,电极反应式为LixC6-xe-=xLi++C6,则Li1一xCoO2所在电极为正极,电极反应式为xLi++xe-+L1-x CoO2═LiCoO2;根据电解池中物质转化:H2O→H2可知,电解池右侧为阴极,电极反应式为2H2O+2e-=2OH-+H2↑,与原电池的负极相接,即b电极为原电池的负极、a电极为原电池的正极,电解池的左侧为电解池的阳极,发生失去电子的氧化反应,电极反应式为2I--2e-=I2,I2发生歧化反应生成IO-,离子方程式为I2+2OH-=I-+IO-+H2O,据此分析解答。
A.根据电解池中H2O→H2可知,电解池右侧为阴极,与原电池的负极相接,即b电极为原电池的负极,则a电极为原电池的正极,电池放电时为原电池,原电池中,阳离子向正极移动,则Li+向a极移动,故A错误;
B.根据分析,a电极为原电池的正极,电极反应式为xLi++xe-+L1-x CoO2═LiCoO2;电池充电时,a电极为电解池的阳极,电极反应式为LiCoO2-xe-=Lil-xCoO2+xLi+,故B正确;
C.由于阳极区还发生I2+2OH=I+IO+H2O的反应,反应条件为碱性,阴极反应式为2H2O+2e=2OH+H2↑,OH-应通过交换膜M进入阳极区,所以M为阴离子交换膜,故C错误;
D.根据图示,苯乙酮与IO发生氧化还原反应,生成苯甲酸盐和CHI3,苯乙酮被氧化,IO被还原,根据得失电子守恒、原子守恒和电荷守恒,反应为 +3IO→
+3IO→![]() + CHI3+2OH-,故D正确;
+ CHI3+2OH-,故D正确;
答案选BD。


科目:高中化学 来源: 题型:
【题目】某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0°C | 0.5 molL1稀硫酸 | 4 min 左右出现蓝色 |
② | 20°C | 1 min 左右出现蓝色 | ||
③ | 20°C | 0.1 molL1稀硫酸 | 15 min 左右出现蓝色 | |
④ | 20°C | 蒸馏水 | 30 min 左右出现蓝色 |
(1)为探究温度对反应速率的影响,实验②中试剂 A 应为______________。
(2)写出实验③中 I-反应的离子方程式:_____________________。
(3)对比实验②③④,可以得出的结论:_______________________。
(继续探究)溶液 pH 对反应速率的影响查阅资料:
i.pH<11.7 时,I-能被O2 氧化为 I2。
ii.pH= 9.28 时,I2发生歧化反应:3I2 +6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快。
(4)小组同学用 4 支试管在装有 O2 的储气瓶中进行实验,装置如图所示。
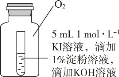
序号 | ⑤ | ⑥ | ⑦ | ⑧ |
试管中溶液的 pH | 8 | 9 | 10 | 11 |
放置 10 小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
分析⑦和⑧中颜色无明显变化的原因_______。
(5)甲同学利用原电池原理设计实验证实 pH=10 的条件下确实可以发生 I-被 O2 氧化为 I2 的反应,如图所示,请你填写试剂和实验现象。
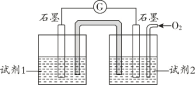
试剂1______________。 试剂2______________。实验现象:___________________________。
(深入探究)较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
序号 | 温度 | 试剂 | 现象 |
⑨敞口试管 | 水浴 70°C | 5 mL 1 molL1 KI 溶液 5 mL 0.5 molL1 稀硫酸 | 20 min 内仍保持无色,冷却至室温后滴加淀粉溶液出现蓝色 |
⑩密闭试管 | 溶液迅速出现黄色,且黄色逐渐加深,冷却至室温后滴加淀粉溶液出现蓝色 |
(6)对比实验⑨和⑩的现象差异,该小组同学对实验⑨中的现象提出两种假设,请你补充假设 1。
假设 1:_______________。
假设 2:45°C 以上 I2 易升华,70°C 水浴时,c(I2)太小难以显现黄色。
(7)针对假设 2 有两种不同观点。你若认为假设 2 成立,请推测试管⑨中“冷却至室温后滴加淀粉出现蓝色”的可能原因_______________(写出一条)。你若认为假设 2 不成立,请设计实验方案证明_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞。则下列有关说法正确的是( )
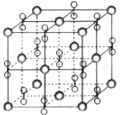
A. 晶体中与每个K+距离最近的O2-有6个
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. KO2中阴、阳离子个数比为1:2
D. 晶体中所有原子之间都以离子键结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)A为__________(写出元素符号),电子排布式是_____________;
(2)C为________(写出元素符号),价电子排布式是________________;
(3)D的电子排布图是__________;
(4)E的原子结构示意图是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Fe3O4/Pd为催化材料,利用电化学原理实现H2消除酸性废水中的![]() ,其反应过程如图所示[已知Fe3O4中Fe元素化合价为+2、+3价,分别表示为Fe(Ⅱ)、Fe(Ⅲ)]。下列说法错误的是
,其反应过程如图所示[已知Fe3O4中Fe元素化合价为+2、+3价,分别表示为Fe(Ⅱ)、Fe(Ⅲ)]。下列说法错误的是
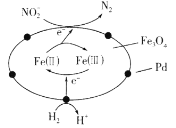
A.处理![]() 的电极反应为2NO2-+8H++6e-=N2↑+4H2O
的电极反应为2NO2-+8H++6e-=N2↑+4H2O
B.Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C.用该法处理后,水体的pH降低
D.消耗标准状况下6.72LH2,理论上可处理含NO2-4.6mg·L-1的废水2m3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的AOH和BOH两种碱的稀溶液,加水稀释至原体积的n倍。两溶液稀释倍数的对数值(lgn)与溶液的pH变化关系如图所示。下列叙述正确的是
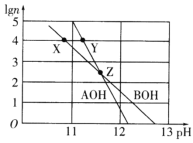
A.水的电离程度:Z>X=Y
B.常温下,Kb(BOH)<Kb(AOH)
C.中和等体积X、Y两点溶液,后者消耗HC1的物质的量多
D.物质的量浓度相同的AC1溶液和BC1溶液,前者阳离子浓度之和小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,Y原子是最轻的原子,人们曾预言它可能是所有元素之母。
(1)X基态原子的电子排布式为___。
(2)C、H、O、N四种原子的电负性由大到小的顺序为___。
(3)Y负离子基态电子排布式为___。
(4)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ/mol,H(g)=H+(g)+e-吸收的能量为1311kJ/mol,则氢负离子的第一电离能为__。
(5)水溶液中有H3O+、H5O![]() 、H9O
、H9O![]() 等微粒的形式。H3O+中,中心原子的杂化类型是__,请画出H5O
等微粒的形式。H3O+中,中心原子的杂化类型是__,请画出H5O![]() 的结构式:__。
的结构式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年,我国科学家研发出一种新型的锌碘单液流电池,已知M为阴离子交换膜,其原理如图所示。下列说法不正确的是
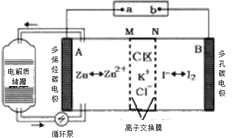
A.放电时A电极反应式为:Zn-2e﹣= Zn2+
B.充电时,B极与外接电源正极相连
C.放电时电解质储罐中离子浓度增大
D.放电时当A极减少65g时,C区Cl﹣增加2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() —NMR(核磁共振)、
—NMR(核磁共振)、![]() —NMR可用于测定蛋白质、核酸等生物大分子的空间结构,瑞士科学家库尔特、维特里希等人为此获得诺贝尔化学奖。下列有关
—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,瑞士科学家库尔特、维特里希等人为此获得诺贝尔化学奖。下列有关![]() 、
、![]() 的叙述正确的是( )
的叙述正确的是( )
A. ![]() 与
与![]() 互为同位素B.
互为同位素B. ![]() 与C60互为同素异形体
与C60互为同素异形体
C. ![]() 、
、![]() 具有相同的中子数D.
具有相同的中子数D. ![]() 的核外电子数与中子数相同
的核外电子数与中子数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com