
【题目】以Fe3O4/Pd为催化材料,利用电化学原理实现H2消除酸性废水中的![]() ,其反应过程如图所示[已知Fe3O4中Fe元素化合价为+2、+3价,分别表示为Fe(Ⅱ)、Fe(Ⅲ)]。下列说法错误的是
,其反应过程如图所示[已知Fe3O4中Fe元素化合价为+2、+3价,分别表示为Fe(Ⅱ)、Fe(Ⅲ)]。下列说法错误的是
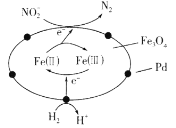
A.处理![]() 的电极反应为2NO2-+8H++6e-=N2↑+4H2O
的电极反应为2NO2-+8H++6e-=N2↑+4H2O
B.Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C.用该法处理后,水体的pH降低
D.消耗标准状况下6.72LH2,理论上可处理含NO2-4.6mg·L-1的废水2m3
【答案】C
【解析】
A.根据图示,处理![]() 得到电子转化为氮气,电极反应为2NO2-+8H++6e-=N2↑+4H2O,故A正确;
得到电子转化为氮气,电极反应为2NO2-+8H++6e-=N2↑+4H2O,故A正确;
B.Fe(Ⅲ)得电子生成Fe(Ⅱ),Fe(Ⅱ)失电子生成Fe(Ⅲ),则Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用,故B正确;
C.根据图示,总反应方程式可知:2H++2NO2+3H2![]() N2+4H2O,所以用该法处理后水体的pH升高,故C错误;
N2+4H2O,所以用该法处理后水体的pH升高,故C错误;
D.根据C项的总反应2H++2NO2+3H2![]() N2+4H2O,消耗标准状况下6.72LH2即为
N2+4H2O,消耗标准状况下6.72LH2即为![]() =0.3mol,理论上可处理NO2-的物质的量=
=0.3mol,理论上可处理NO2-的物质的量=![]() ×0.3mol=0.2mol,可处理含4.6mg·L-1 NO2-废水的体积=
×0.3mol=0.2mol,可处理含4.6mg·L-1 NO2-废水的体积=![]() =2×103L=2m3,故D正确;
=2×103L=2m3,故D正确;
答案选C。


科目:高中化学 来源: 题型:
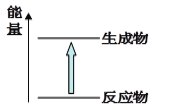
【题目】下列化学反应中的说法错误的是( )
A. 化学反应中有物质变化也有能量变化。
B. 化学键断裂吸收能量,化学键生成放出能量。
C. 需要加热的化学反应不一定是吸热反应。
D. 如图所示的反应为放热反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+ 原子核外有3层电子且M层3d轨道电子全充满。请回答:
(1)E元素基态原子的电子排布式为_________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为____(填元素符号)
(3)D元素与氟元素相比,电负性:D______F(填“>”、“=”或“<”),下列表述中能证明这一事实的是_______(填选项序号)
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物,其电子式为______,它的晶体中含有多种化学键,但一定不含有的化学键是______(填选项序号)。
A.极性键 B.非极性键 C.离子键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含![]() 键______mol。
键______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
|
|
|
|
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。某高能锂离子电池的反应方程式为![]() (x<1)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸的装置如图所示(苯甲酸盐溶液酸化后可以析出苯甲酸)。下列说法正确的是
(x<1)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸的装置如图所示(苯甲酸盐溶液酸化后可以析出苯甲酸)。下列说法正确的是
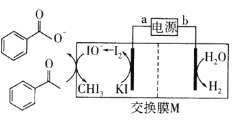
A.电池放电时,Li+向b极移动
B.电池充电时,a极反应式为LiCoO2-xe-=Lil-xCoO2+xLi+
C.M为阳离子交换膜
D.生成苯甲酸盐的反应为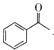 +3IO→
+3IO→![]() + CHI3+2OH-
+ CHI3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究SO2与AgNO3溶液的反应,实验记录如下:
序号 | Ⅰ | Ⅱ | Ⅲ |
实验 步骤 |
|
|
|
实验现象 | 得到无色溶液a和白色沉淀b | 产生无色气体,遇空气变为红棕色 | 产生白色沉淀 |
下列说法正确的是
A.透过测Ⅰ中无色溶液a的pH可以判断SO2是否被氧化
B.实验Ⅱ说明白色沉淀b具有还原性
C.实验Ⅲ说明溶液a中一定有![]() 生成
生成
D.实验Ⅰ、Ⅱ、Ⅲ说明SO2与AgNO3溶液反应既有Ag2SO4生成,又有Ag2SO3生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
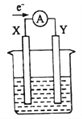
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究K2Cr2O7溶液中的化学平衡,设计如图所示实验。已知:Cr2O72-+H2O![]() 2CrO42-+2H+△H=+13.8kJ/mol。实验现象如下:
2CrO42-+2H+△H=+13.8kJ/mol。实验现象如下:
i.试管a中溶液为橙色;
ii.试管b中溶液为黄色;
iii.试管c中滴加浓硫酸后温度略有升高,溶液变为深橙色。
下列说法正确的是
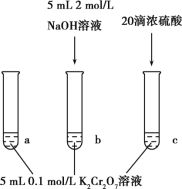
A.该反应是一个氧化还原反应
B.b试管中不存在Cr2O72-
C.该实验不能证明减小生成物浓度平衡正向移动
D.试管c中影响平衡的主要因素是温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com