
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+ 原子核外有3层电子且M层3d轨道电子全充满。请回答:
(1)E元素基态原子的电子排布式为_________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为____(填元素符号)
(3)D元素与氟元素相比,电负性:D______F(填“>”、“=”或“<”),下列表述中能证明这一事实的是_______(填选项序号)
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物,其电子式为______,它的晶体中含有多种化学键,但一定不含有的化学键是______(填选项序号)。
A.极性键 B.非极性键 C.离子键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含![]() 键______mol。
键______mol。
【答案】1s22s22p63s23p63d104s1 C<O<N < BC 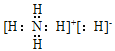 BD 5
BD 5
【解析】
A原子所处的周期数、族序数都与其原子序数相等,A是H元素; B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,B是C元素;D原子L层上有2对成对电子,可知D是O元素;A、B、C、D、E五种元素的原子序数依次增大,可知C是N元素;E+ 原子核外有3层电子且M层3d轨道电子全充满,可知E是Cu元素。
(1)E为Cu,Cu的原子序数为29,基态Cu的电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)B、C、D三种元素分别是C、N、O元素,三种元素都处于第二周期,同周期元素的第一电离能呈增大趋势,N的2p能级为半充满结构,较稳定,第一电离能比O大,则第一电离能数值由小到大的顺序为C<O<N,故答案为:C<O<N;
(3)同周期从左到右元素的电负性逐渐增大,D为O元素,O电负性小于F;
A项,常温下氟气的颜色比D单质的颜色深,颜色属于物理性质,与电负性无关;
B项,氟气与D的氢化物剧烈反应,产生D的单质,说明F的非金属性强于O,非金属性越强电负性越大,能说明F的电负性大于O的电负性;
C项,氟与D形成的化合物中D元素呈正价态,说明F得电子能力强于O,F的非金属性强于O,非金属性越强电负性越大,能说明F的电负性大于O的电负性;
D项,比较两元素的单质与氢气化合时得电子的数目 ,得电子数目多少不能说明得电子能力的强弱,不能说明电负性的大小;
故答案为:BC;
(4)只含A、C两元素的离子化合物为NH4H,其电子式为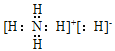 ,其中含有极性键和离子键,不含非极性键和金属键,故答案为:
,其中含有极性键和离子键,不含非极性键和金属键,故答案为: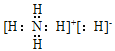 ;BD;
;BD;
(5)B2A4为C2H4,其结构简式为CH2=CH2,1个C2H4分子中含有4个C—H键和1个C=C键,单键全为σ键,双键中含1个σ键和1个π键,则lmolC2H4分子中σ键5mol。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列关于原子结构的说法中正确的是
A.卢瑟福根据![]() 粒子散射现象提出“葡萄干面包式”的原子结构模型
粒子散射现象提出“葡萄干面包式”的原子结构模型
B.原子中,核对核外电子吸引作用实质是核内的质子对核外电子的吸引
C.质子数决定元素的种类,中子数决定核素的种类
D.所有的原子都含有质子、中子和电子3种基本粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气污染物SO2、CH3OH与H2O之间的反应,有利于揭示雾霾的形成机理。
反应i:![]()
反应ii:![]()
(1)CH3OSO3H发生水解:![]() △H=______kJ/mol。
△H=______kJ/mol。
(2)T℃时,反应ii的CH3OH(g)、SO3(g)的初始浓度分别为![]() ,平衡时SO3转化率为0.04%,则K=_____________。
,平衡时SO3转化率为0.04%,则K=_____________。
(3)我国科学家利用计算机模拟计算,分别研究反应ii在无水和有水条件下的反应历程,如图所示,其中分子间的静电作用力用“…”表示。
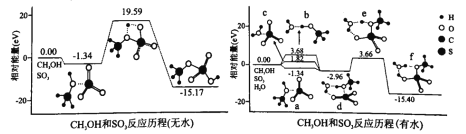
①分子间的静电作用力最强的是_____________(填“a”、“b”或“c”)。
②水将反应ii的最高能垒由_____________eV降为_____________eV。
③d到f转化的实质为质子转移,该过程断裂的化学键为____(填标号)。
A.CH3OH中的氢氧键B.CH3OH中的碳氧键
C.H2O中的氢氧键D.SO3中的硫氧键
(4)分别研究大气中H2O、CH3OH的浓度对反应i、反应ii产物浓度的影响,结果如图所示。
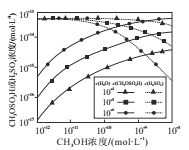
①当c(CH3OH)大于10-11mol.L-1时,c(CH3OH)越大,c(H2SO4)越小的原因是_____________。
②当c(CH3OH)小于10-11mol.L-1时,c(H2O)越大,c(CH3OSO3H)越小的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞。则下列有关说法正确的是( )
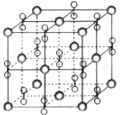
A. 晶体中与每个K+距离最近的O2-有6个
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. KO2中阴、阳离子个数比为1:2
D. 晶体中所有原子之间都以离子键结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是最常见的二次电池。由于铅蓄电池的性能优良、价格低廉、安全可靠,可多次充放电,所以在生产生活中使用广泛,汽车等机动车辆多数都使用这种蓄电池。
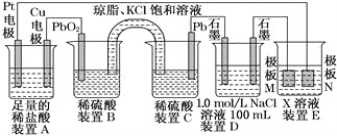
(1)装置B中PbO2上发生的电极反应方程式为______________。
(2)装置A中总反应的离子方程式为____________。
(3)盐桥中的______(填离子符号)向装置C中溶液方向移动。
(4)若装置E中的目的是精炼铜,则X为________,极板M的材料为________(填“粗铜”或“精铜”)。M电极质量改变6.4g时,N极质量变化_________6.4g,(填“大于”、 “小于”、“等于”或“无法确定”),装置D中产生的气体体积为_______L(标准状况下),溶液的pH______(填“增大”或“减小”,忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)A为__________(写出元素符号),电子排布式是_____________;
(2)C为________(写出元素符号),价电子排布式是________________;
(3)D的电子排布图是__________;
(4)E的原子结构示意图是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Fe3O4/Pd为催化材料,利用电化学原理实现H2消除酸性废水中的![]() ,其反应过程如图所示[已知Fe3O4中Fe元素化合价为+2、+3价,分别表示为Fe(Ⅱ)、Fe(Ⅲ)]。下列说法错误的是
,其反应过程如图所示[已知Fe3O4中Fe元素化合价为+2、+3价,分别表示为Fe(Ⅱ)、Fe(Ⅲ)]。下列说法错误的是
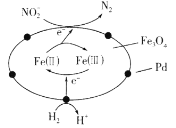
A.处理![]() 的电极反应为2NO2-+8H++6e-=N2↑+4H2O
的电极反应为2NO2-+8H++6e-=N2↑+4H2O
B.Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C.用该法处理后,水体的pH降低
D.消耗标准状况下6.72LH2,理论上可处理含NO2-4.6mg·L-1的废水2m3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,Y原子是最轻的原子,人们曾预言它可能是所有元素之母。
(1)X基态原子的电子排布式为___。
(2)C、H、O、N四种原子的电负性由大到小的顺序为___。
(3)Y负离子基态电子排布式为___。
(4)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ/mol,H(g)=H+(g)+e-吸收的能量为1311kJ/mol,则氢负离子的第一电离能为__。
(5)水溶液中有H3O+、H5O![]() 、H9O
、H9O![]() 等微粒的形式。H3O+中,中心原子的杂化类型是__,请画出H5O
等微粒的形式。H3O+中,中心原子的杂化类型是__,请画出H5O![]() 的结构式:__。
的结构式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
G是功能高分子材料。以甲苯为原料合成G的一种流程如下(部分条件和产物略去)。
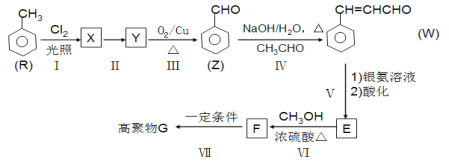
回答下列问题:
(1)W中官能团名称是:_______________________;反应Ⅰ的类型是_________________。
(2)反应Ⅱ的试剂和条件是____________、_______________;Z的名称是______________。
(3)写出F→G的化学方程式:_________________。
(4)T是E的同分异构体,T的苯环上有3个互不相同的取代基,T的结构有______种。
(5)W分子中最多有______个原子共平面。
(6)以乙醇为原料,经过三步合成正丁醇。参照上述流程图设计合成路线。___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com