
【题目】研究大气污染物SO2、CH3OH与H2O之间的反应,有利于揭示雾霾的形成机理。
反应i:![]()
反应ii:![]()
(1)CH3OSO3H发生水解:![]() △H=______kJ/mol。
△H=______kJ/mol。
(2)T℃时,反应ii的CH3OH(g)、SO3(g)的初始浓度分别为![]() ,平衡时SO3转化率为0.04%,则K=_____________。
,平衡时SO3转化率为0.04%,则K=_____________。
(3)我国科学家利用计算机模拟计算,分别研究反应ii在无水和有水条件下的反应历程,如图所示,其中分子间的静电作用力用“…”表示。
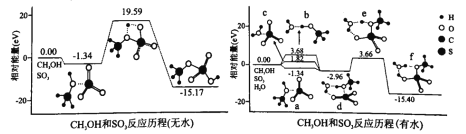
①分子间的静电作用力最强的是_____________(填“a”、“b”或“c”)。
②水将反应ii的最高能垒由_____________eV降为_____________eV。
③d到f转化的实质为质子转移,该过程断裂的化学键为____(填标号)。
A.CH3OH中的氢氧键B.CH3OH中的碳氧键
C.H2O中的氢氧键D.SO3中的硫氧键
(4)分别研究大气中H2O、CH3OH的浓度对反应i、反应ii产物浓度的影响,结果如图所示。
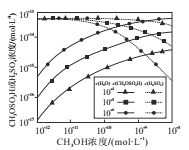
①当c(CH3OH)大于10-11mol.L-1时,c(CH3OH)越大,c(H2SO4)越小的原因是_____________。
②当c(CH3OH)小于10-11mol.L-1时,c(H2O)越大,c(CH3OSO3H)越小的原因是_____________。
【答案】-164.4 4×104L·mol-1 a 20.93 6.62 ACD 反应i和反应ii为竞争反应,甲醇浓度增大,促进了甲醇和三氧化硫反应,抑制了三氧化硫和水的反应,硫酸的浓度减小 水的浓度越大,甲醇和三氧化硫碰撞几率越小,生成CH3OSO3H越小,c(CH3OSO3H)越小
【解析】
(3)图形很陌生,但仔细观察发现其实是反应历程与能量变化图,问题就变简单了。
(4)反应i和反应ii为竞争反应,两个反应都消耗三氧化硫,三氧化硫浓度不变的情况下,一个反应程度增大另一个反应程度一定减小。
(1) 反应i:![]()
反应ii:![]()
反应i-反应ii有:![]() ,所以
,所以![]() =
=![]() -
-![]() =(
=(![]() )-(
)-(![]() )=-164.4
)=-164.4![]() ,故答案为:-164.4;
,故答案为:-164.4;
(2)SO3转化率为0.04%,则SO3转化值=![]() ×0.04%=8×10-13mol·L-1,列三段式如下:
×0.04%=8×10-13mol·L-1,列三段式如下: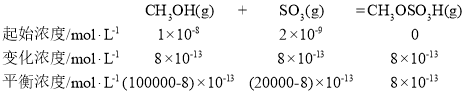 ,K=
,K=![]() ≈
≈![]() =4×104L·mol-1,故答案为:4×104L·mol-1;
=4×104L·mol-1,故答案为:4×104L·mol-1;
(3)①a处的两个分子能量更低,更稳定,分子间静电作用更强,故答案为:a;
②无水时,反应ii的最高能垒为19.59eV-(-1.34eV)=20.93eV,有水时,反应ii的最高能垒为3.66eV-(-2.96eV)=6.62eV,即水将反应ii的最高能垒由20.93eV降为6.62eV,故答案为:20.93;6.62;
③由图可知,水分子中的氢氧键断了一根,又形成一根;CH3OH中的氢氧键断了,O和S原子重新形成一根键;SO3中硫氧双键断了一根,变成硫氧单键,S和甲醇中的O重新形成一根单键,综上所述,水中的氢氧键、甲醇中的氢氧键、三氧化硫中的硫氧键都发生了断裂,ACD符合,故答案为:ACD;
(4)①反应i和反应ii都消耗三氧化硫,为竞争反应,甲醇浓度增大,促进了甲醇和三氧化硫反应,抑制了三氧化硫和水的反应,硫酸的浓度减小,故答案为:反应i和反应ii为竞争反应,甲醇浓度增大,促进了甲醇和三氧化硫反应,抑制了三氧化硫和水的反应,硫酸的浓度减小;
②水的浓度越大,甲醇和三氧化硫碰撞几率越小,生成CH3OSO3H减小,c(CH3OSO3H)减小,故答案为:水的浓度越大,甲醇和三氧化硫碰撞几率越小,生成CH3OSO3H越少,c(CH3OSO3H)越小。


科目:高中化学 来源: 题型:
【题目】(1)乙烯、乙炔、甲苯、苯乙烯(![]() )4种有机物分别在一定条件下与H2充分反应。
)4种有机物分别在一定条件下与H2充分反应。
①若烃与H2反应的物质的量之比为1∶3,说明该烃分子中存在______________结构,它是________________________________________________________________________。
②若烃与H2反应的物质的量之比为1∶2,说明该烃分子中存在________________结构,它是________________________________________________________________________。
③苯乙烯与H2完全加成的物质的量之比为________。
(2)按分子结构决定性质的观点可推断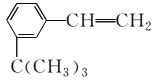 有如下性质:
有如下性质:
①苯基部分可发生______反应和________反应;
②—CH===CH2部分可发生_______反应和_______反应;
③该有机物滴入溴水后生成产物的结构简式为__________;滴入酸性高锰酸钾溶液后生成产物的结构简式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
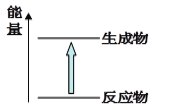
【题目】下列化学反应中的说法错误的是( )
A. 化学反应中有物质变化也有能量变化。
B. 化学键断裂吸收能量,化学键生成放出能量。
C. 需要加热的化学反应不一定是吸热反应。
D. 如图所示的反应为放热反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:3A(g)+B(g) = 2C(g) +2D(g),在不同条件下,用不同物质表示其反应速率,分别为:
①v(A)=0.6 mol/(L·min) ②v(B)=0.45 mol/(L·min)
③v(C)=0.015 mol/(L·min) ④v(D)=0.45 mol/(L·min)
则此反应在不同条件下进行最快的是( )
A.①B.②C.③D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.02mol·L-1CuSO4溶液中匀速滴加1mol·L-1氨水,先观察到有浅蓝色沉淀[Cu2(OH)2SO4]生成,后沉淀溶解,逐渐变为深蓝色溶液。该实验过程体系的pH和电导率随时间的变化如图所示。下列说法正确的是
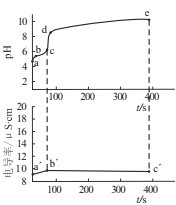
A.c(Cu2+):a点=b点
B.bc段生成浅蓝色沉淀的反应为![]()
C.d点时:![]()
D.导电能力:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L恒容的密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图。据图回答:
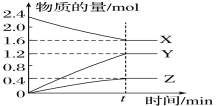
(1)该反应的化学方程式可表示为_______________________________________________。
(2)反应起始至t min(设t=5),X的平均反应速率是________________。
(3)在t min时,该反应达到了____________状态,下列可判断反应已达到该状态的是________(填字母,下同)。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为2∶3
C.混合气体的密度不变 D.生成1molZ的同时生成2molX
(4)从开始到t秒末X的转化率__________。
(5)用一定能使该反应的反应速率增大的措施有________。
A.其他条件不变,及时分离出产物 B.适当降低温度
C.其他条件不变,增大X的浓度 D.保持体积不变,充入Ar气使容器内压强增大
(6)在一个体积固定的密闭容器中,进行的可逆反应A(s)+3B(g) ![]() 3C (g)。下列叙述中表明可逆反应一定达到平衡状态的是 __________
3C (g)。下列叙述中表明可逆反应一定达到平衡状态的是 __________
①C的生成速率与C的分解速率相等;
②单位时间内生成a mol A,同时生成3a mol B;
③B的浓度不再变化;
④混合气体总的物质的量不再发生变化;
⑤A、B、C的物质的量之比为1∶3∶3;
⑥混合气体的密度不再变化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+ 原子核外有3层电子且M层3d轨道电子全充满。请回答:
(1)E元素基态原子的电子排布式为_________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为____(填元素符号)
(3)D元素与氟元素相比,电负性:D______F(填“>”、“=”或“<”),下列表述中能证明这一事实的是_______(填选项序号)
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物,其电子式为______,它的晶体中含有多种化学键,但一定不含有的化学键是______(填选项序号)。
A.极性键 B.非极性键 C.离子键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含![]() 键______mol。
键______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
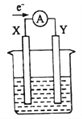
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com