
【题目】向0.02mol·L-1CuSO4溶液中匀速滴加1mol·L-1氨水,先观察到有浅蓝色沉淀[Cu2(OH)2SO4]生成,后沉淀溶解,逐渐变为深蓝色溶液。该实验过程体系的pH和电导率随时间的变化如图所示。下列说法正确的是
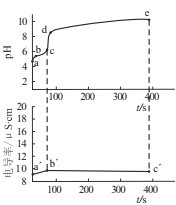
A.c(Cu2+):a点=b点
B.bc段生成浅蓝色沉淀的反应为![]()
C.d点时:![]()
D.导电能力:![]()
【答案】D
【解析】
c到d溶液pH突变,说明c点沉淀达到最大值,a到c发生生成沉淀的反应:![]() ,c到e发生沉淀溶解反应:
,c到e发生沉淀溶解反应:![]() +
+![]() =2
=2![]() +8H2O+SO42-+2OH-,据此分析解答。
+8H2O+SO42-+2OH-,据此分析解答。
A.a到b发生![]() ,c(Cu2+)减小,故c(Cu2+):a点>b点,A错误;
,c(Cu2+)减小,故c(Cu2+):a点>b点,A错误;
B.bc段生成浅蓝色沉淀的反应为![]() 、而不是
、而不是![]() ,B错误;
,B错误;
C.c点沉淀达到最大值,此时溶质为(NH4)2SO4,c到d,pH突变,但导电率几乎不变,故d点,溶质为(NH4)2SO4和![]() ,那么d点溶液中电荷守恒为:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),因此时pH>7,c(H+)<c(OH-),故c(NH4+)>2c(SO42-),C错误;
,那么d点溶液中电荷守恒为:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),因此时pH>7,c(H+)<c(OH-),故c(NH4+)>2c(SO42-),C错误;
D.b’点之前释放NH4+,导电能力增强,b’之后释放![]() 和OH-,导电能力降低,说明导电能力
和OH-,导电能力降低,说明导电能力![]() ,D正确。
,D正确。
答案选D。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
A.  ―→
―→
B. CH2===CH—CH2—CH3+HCl![]()
C. CH3—CH===CH2+H2O![]()
D. nCH2===CH2+nCH2===CH—CH3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3 mol A和3 mol B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.15 mol/(L·min)。试求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.15 mol/(L·min)。试求:
(1)5 min后A的浓度__________________。
(2)B的平均反应速率为___________________。
(3)x的值为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案设计中,无法达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 除去NaCl固体中少量的KNO3杂质 | 将固定溶于水配成溶液,蒸发结晶并趁热过滤 |
B | 检验乙酸乙酯中是否含有乙酸 | 加入含有酚酞的NaOH溶液并振荡,观察下层溶液颜色变化 |
C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化 |
D | 比较Fe3+和I2的氧化性强弱 | 向含有淀粉的KI溶液中滴入FeCl3溶液,观察溶液颜色变化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)①H3PO2是一元中强酸,写出其电离方程式______________________。
②NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显___________(填“弱酸性”“中性”或“弱碱性”)。
③H3PO2中,P元素的化合价为___________;
(2)H3PO2可用于化学镀银,反应中Ag+还原为银,H3PO2氧化为H3PO4,该反应中氧化剂与还原剂的物质的量之比为________。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4 反应,写出白磷与Ba(OH)2溶液反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气污染物SO2、CH3OH与H2O之间的反应,有利于揭示雾霾的形成机理。
反应i:![]()
反应ii:![]()
(1)CH3OSO3H发生水解:![]() △H=______kJ/mol。
△H=______kJ/mol。
(2)T℃时,反应ii的CH3OH(g)、SO3(g)的初始浓度分别为![]() ,平衡时SO3转化率为0.04%,则K=_____________。
,平衡时SO3转化率为0.04%,则K=_____________。
(3)我国科学家利用计算机模拟计算,分别研究反应ii在无水和有水条件下的反应历程,如图所示,其中分子间的静电作用力用“…”表示。
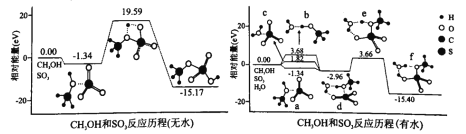
①分子间的静电作用力最强的是_____________(填“a”、“b”或“c”)。
②水将反应ii的最高能垒由_____________eV降为_____________eV。
③d到f转化的实质为质子转移,该过程断裂的化学键为____(填标号)。
A.CH3OH中的氢氧键B.CH3OH中的碳氧键
C.H2O中的氢氧键D.SO3中的硫氧键
(4)分别研究大气中H2O、CH3OH的浓度对反应i、反应ii产物浓度的影响,结果如图所示。
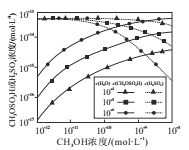
①当c(CH3OH)大于10-11mol.L-1时,c(CH3OH)越大,c(H2SO4)越小的原因是_____________。
②当c(CH3OH)小于10-11mol.L-1时,c(H2O)越大,c(CH3OSO3H)越小的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,科学家研发出一种新型质子膜电池,下列有关说法正确的是( )

A.电流方向为由电极a流向电极bB.a电极反应式:2H2S-4e- =S2+4H+
C.用此电源电解精炼铜,粗铜接在a电极D.该装置中H+由电极b经质子膜移动到电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是最常见的二次电池。由于铅蓄电池的性能优良、价格低廉、安全可靠,可多次充放电,所以在生产生活中使用广泛,汽车等机动车辆多数都使用这种蓄电池。
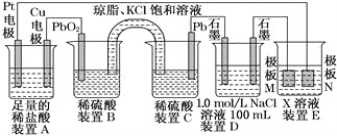
(1)装置B中PbO2上发生的电极反应方程式为______________。
(2)装置A中总反应的离子方程式为____________。
(3)盐桥中的______(填离子符号)向装置C中溶液方向移动。
(4)若装置E中的目的是精炼铜,则X为________,极板M的材料为________(填“粗铜”或“精铜”)。M电极质量改变6.4g时,N极质量变化_________6.4g,(填“大于”、 “小于”、“等于”或“无法确定”),装置D中产生的气体体积为_______L(标准状况下),溶液的pH______(填“增大”或“减小”,忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)制取铜的操作流程如下:
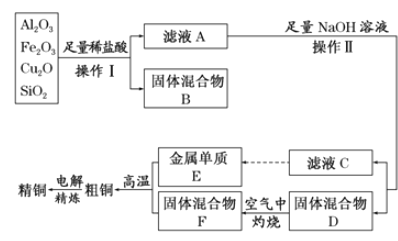
已知:Cu2O+2H+===Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为_________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为__________,检验滤液A中存在该离子的试剂为_____________(填试剂名称)。
(3)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为___________
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=________。
(5)利用电解法进行粗铜精炼时,下列叙述正确的是__________(填代号)。
a 电能全部转化为化学能
b 粗铜接电源正极,发生氧化反应
c 精铜作阴极,电解后电解液中Cu2+浓度减小
d 粗铜精炼时通过的电量与阴极析出铜的量无确定关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com