
【题目】如图所示,科学家研发出一种新型质子膜电池,下列有关说法正确的是( )

A.电流方向为由电极a流向电极bB.a电极反应式:2H2S-4e- =S2+4H+
C.用此电源电解精炼铜,粗铜接在a电极D.该装置中H+由电极b经质子膜移动到电极a
【答案】B
【解析】
根据图示可知电极反应为:2H2S(g)+O2(g)=S2(s)+2H2O反应,得出负极为a,H2S在负极上失电子发生氧化反应,正极为b,O2在正极上得电子发生还原反应,电子从负极流向正极,a电极反应式:2H2S-4e- =S2+4H+,b电极的电极反应为:O2+4H++4e=2H2O,据此分析。
A.电子的流向为从负极到正极,负极为a,正极为b,电子流动方向为由电极a流向电极b,电流的方向与电子的流向相反,b流向电极a,故A错误;
B.根据反应:2H2S(g)+O2(g)=S2(s)+2H2O,得出负极为a,H2S在负极上失电子发生氧化反应,a电极反应式:2H2S- 4e- =S2+4H+,故B正确;
C.此电源为燃料电池,是原电池,用此电源电解精炼铜,粗铜接在阳极,b电极为阳极,粗铜接在b电极,故C错误;
D.由电极反应可知,氢离子在a电极上产生,在b电极上消耗,该装置中H+由a电极经质子膜移动到电极b,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】如图是A、B、C三种固体物质的溶解度曲线。
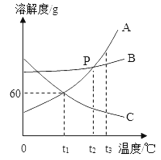
(1)P点表示的含义是__。
(2)t1℃时,将35gA物质加入到50g水中,形成___(填“饱和”或“不饱和”)溶液。
(3)B中混有少量的A,提纯B的方法是__。
(4)将等质量的A、B、C三种固体物质分别配成t3℃时的饱和溶液,所得溶液的质量最多的是___。
(5)将t1℃时A、B、C三种物质的饱和溶液升温到t3℃时,所得溶液的溶质质量分数由大到小的关系是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mLNH4HCO3和Na2CO3的混合溶液分为五等分,取一份加入含amol氢氧化钠的溶液恰好反应完全,另取一份加入含bmolHCl的盐酸恰好反应至不再产生CO2,则该混合溶液中c(Na+)为( )
A. (![]() )molL-1
)molL-1
B. (2b-a)molL-1
C. (5b-![]() )molL-1
)molL-1
D. (10b-5a)molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.02mol·L-1CuSO4溶液中匀速滴加1mol·L-1氨水,先观察到有浅蓝色沉淀[Cu2(OH)2SO4]生成,后沉淀溶解,逐渐变为深蓝色溶液。该实验过程体系的pH和电导率随时间的变化如图所示。下列说法正确的是
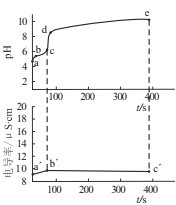
A.c(Cu2+):a点=b点
B.bc段生成浅蓝色沉淀的反应为![]()
C.d点时:![]()
D.导电能力:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如图所示。
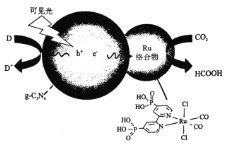
(1)基态碳原子的价电子排布图为_____________。
(2)1molHCOOH中含有的σ键数目为_____________,HCOOH的沸点比CO2高的原因为_____________。
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为_____________
(4)Ru络合物中与Ru配位的原子有N、_____________。
(5)Ru络合物含有的片段![]() 和
和![]() 中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________(填“前者”或“后者”)。
中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________(填“前者”或“后者”)。
(6)一种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。

①g-C3N4中氮原子的杂化类型是_____________。
②根据图2,在图1中用平行四边形画出一个最小重复单元。_____________
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为____g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.若将等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石) ΔH=+1.9kJ/mol可知石墨比金刚石稳定
C.在101kPa时,2g H2完全燃烧生成液态水放出285.8 kJ热量,表示氢气燃烧热的热化学方程式为2H2(g)+O2(g) =2H2O(l) ΔH= -285.8 kJ/mol
D.在稀溶液中:H+(aq)+OH-(aq) =H2O(l) ΔH= -57.3 kJ/mol,若将含1mol H2SO4 与含1mol Ba(OH)2的稀溶液混合,放出的热量等于114.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
|
|
|
|
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学设计实验探究碳、硅元素的非金属性的相对强弱,实验装置如图。根据要求完成下列各题。
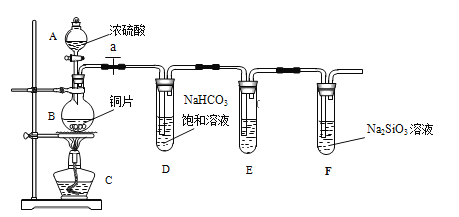
(1)填写所示仪器名称:A__________,B__________。
(2)实验步骤:连接仪器、______________、加药品后,打开 a、滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中装的是酸性KMnO4溶液,其作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填 “能”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com