
【题目】下列说法中,正确的是
A. 甲烷是一种清洁能源,是天然气的主要成分
B. 用KMnO4溶液浸泡过的藻土可使水果保鲜,是利用了乙烯的氧化性
C. 苯不能使KMnO4酸性溶液褪色,说明它是一种饱和烃,很稳定
D. 己烷可以使溴水褪色,说明己烷中含有碳碳双键
科目:高中化学 来源: 题型:
【题目】用Na2CO3·10H2O晶体配制0.20 mol/L Na2CO3溶液480 mL。
(1)实验时要用到的玻璃仪器有:除托盘天平、量筒、烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是___________________,在使用该仪器前必须进行的操作是_______________________。
(2)应用托盘天平称取Na2CO3·10H2O晶体的质量为___________g。
(3)配制溶液时有以下几个操作:

简述定容的过程:_______________________________。
(4)配制过程中,下列操作对所配溶液的浓度有什么影响,完成填空。
a.Na2CO3·10H2O晶体不纯,混有NaCl
b.用“左码右物”的称量方法称量晶体
c.容量瓶中洗净后未干燥,残留少量水
d.未冷却至室温就转移定容
e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出
f.定容时,俯视刻度线
会引起所配溶液的浓度偏大的有________,无影响的有________。(填序号)
(5)如果直接使用浓度为2.00mol/L的Na2CO3溶液来配制100mL 1.00mol/L的Na2CO3溶液,需要量取2.00mol/L的Na2CO3溶液的体积为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B两种烃,其相关信息如下:
A ①完全燃烧的产物中n(CO2):n(H2O)=2:1
②28<M (A)<60
③不能使溴的四氯化碳溶液褪色④一氯代物只有一种结构
B ①饱和链烃,通常情况下呈气态②有同分异构体
③二溴代物有三种
回答下列问题:
(1)烃A的实验式是 ;
(2)烃A的结构简式是 ;
(3)烃B的三种二溴代物的结构简式为 、 、 ;
(4)烃C为烃B的同系物,常温下为气态且只有一种一溴代物,则烃C的一溴代物的结构简式为 (填一种即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醛或酮可与格林试剂R1MgX反应,所得产物经水解可得醇,如

若用此种方法制取HOC(CH3)2CH2CH3,可选用的醛或酮与格林试剂是( )
A. 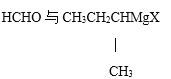 B.
B. 
C. CH3CH2CHO与 CH3CH2MgX D. 丙酮与CH3CH2MgX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. E的产量是衡量一个国家石油化工水平发展的标志,F为高分子化合物,能进行如图所示的反应。

(1)请写出E的电子式_______________。
(2)下列反应的化学方程式:(要求有机物必须写结构简式)
反应②:________________________ 反应类型________。
反应③:________________________ 反应类型________。
反应④:____________________反应类型________。
反应⑤:____________________反应类型________。
(3)比较反应①剧烈程度_____________(填>、= 或<)钠和水反应的剧烈程度。
Ⅱ.2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:

它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应 B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素” 的分子式是C12H10O5 D.“亮菌甲素”分子中含氧官能团只有2种
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其所有属于醇类的同分异构体的结构简式_______________________________。
(3)依据核磁共振氢谱分析,二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中含碳、氧元素的质量分数相同,且氢元素的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇的结构简式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
乙醇水蒸气重整制氢的部分反应过程如下左图所示:
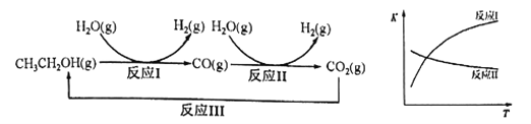
已知:反应Ⅰ和反应Ⅱ的平衡常数随温度变化曲线如上右图所示。
(1)反应Ⅰ中,1molCH3CH2OH(g)参与反应后的热量变化是256kJ。反应1的热化学方程式是_____________________。
(2)反应Ⅱ,在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。
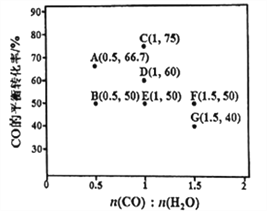
①图中D、E两点对应的反应温度分别为TD和TE判断:TD_______TE (填“<”“=”或“>”)。
②经分析,A、E 和G 三点对应的反应温度相同,其原因是A、E和G三点对应的________相同。
③当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系
是_________________。
(3)反应Ⅲ,在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
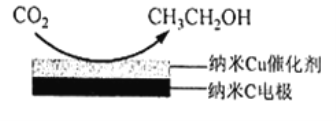
①阴极的电极反应式是____________________。
②从电解后溶液中分离出乙醇的操作方法是_________________。
③直接向KOH溶液中通入CO2,可以获得“经CO2饱和处理的KHCO3电解液”,该过程中浓度先增大后减小的离子是__________________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质检验的实验结论正确的是
选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有 Fe2+ |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
D | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该钾盐是K2CO3 |
A. A B. B C. C D. D
【答案】B
【解析】
白色沉淀可能为AgCl;产生的气体能使澄清石灰水变浑浊,气体为二氧化碳或二氧化硫;先加入硫氰化钾溶液,溶液不显示红色,说明溶液中不存在铁离子,再加入具有氧化性的氯水,溶液变成红色,说明原溶液中一定存在亚铁离子;能使品红褪色的气体不一定为SO2;产生的气体能使澄清石灰水变浑浊,气体为二氧化碳或二氧化硫。
白色沉淀也可能为AgCl,若先加盐酸排除干扰,不生成沉淀,再加氯化钡生成沉淀,则溶液中一定含有SO42-,A错误;向某溶液中加入2滴KSCN溶液,溶液不显红色,说明溶液中不存在铁离子;再向溶液中加入几滴新制的氯水,溶液变为红色,说明加入氯水后溶液中出现了铁离子,证明原溶液中一定含有Fe2+,B正确;能使品红褪色的气体不一定为SO2,也可能为其它强氧化性气体,如氯气、臭氧等,C错误;产生的气体能使澄清石灰水变浑浊,气体可能为二氧化碳或二氧化硫,则溶液中可能含有CO32-、HCO3-,或SO32-、HSO3-,D错误。
【点睛】
本题考查化学实验方案的评价,侧重分析与实验能力的考查,注意实验的评价性分析,把握常见离子的检验、物质的性质、气体的检验等为解答的关键。
【题型】单选题
【结束】
17
【题目】在铜与浓硫酸的反应中,如果转移0.4mol电子,则被还原的硫酸物质的量
A. 0.4mol B. 0.2mol
C. 小于0.4mol D. 小于0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵NH4ClO4是复合火箭推进剂的重要成分,实验室可通过下列反应制取
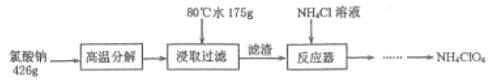
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为___________________________。
(2)反应得到的混合溶液中 NH4ClO4 和 NaCl 的质量分数分别为 0.30 和 0.15, 从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)_______、______、 _______、冰水洗涤、干燥。用冰水洗涤的目的是___________________________________________________。若氯化铵溶液用氨气和浓盐酸代替,则该反应不需要加热就能进行,其原因是_____________。
(3) 样品中NH4ClO4的含量可用蒸馏法进行则定,蒸馏装置如图所示(加热和仪器固定装置已略去),实验步骤如下:
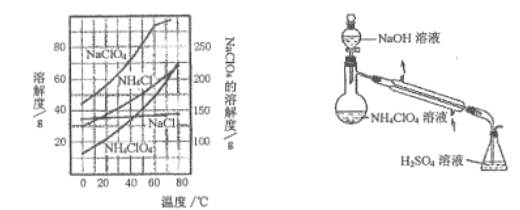
步骤1: 按上图所示组装仪器,检查装置气密性。
步骤2: 准确称取样品a g 于蒸馏烧瓶中,加入150mL 水溶解。
步骤3: 准确量取40.00mL、0.1000mol/L H2SO4溶解于锥形瓶中。
步骤4: 经分液漏斗向蒸馏瓶中加入20.00mL、3mol /LNaOH 溶液。
步骤5: 加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6: 用新煮沸过的水冲洗冷凝装置2--3 次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol/L NaOH 标准溶液滴定剩余H2SO4至终点时消耗NaOH 标准溶液VmL。
①步骤3 中,准确量取40.00mL.H2SO4溶液的玻璃仪器是___________。
②样品中NH4ClO4的质量分数为_______。若取消步骤6,则对定结果的影响是______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com