
【题目】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
乙醇水蒸气重整制氢的部分反应过程如下左图所示:
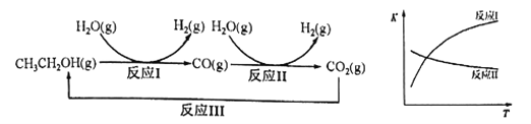
已知:反应Ⅰ和反应Ⅱ的平衡常数随温度变化曲线如上右图所示。
(1)反应Ⅰ中,1molCH3CH2OH(g)参与反应后的热量变化是256kJ。反应1的热化学方程式是_____________________。
(2)反应Ⅱ,在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。
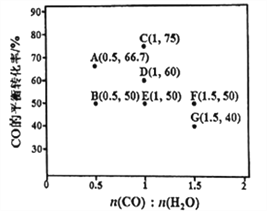
①图中D、E两点对应的反应温度分别为TD和TE判断:TD_______TE (填“<”“=”或“>”)。
②经分析,A、E 和G 三点对应的反应温度相同,其原因是A、E和G三点对应的________相同。
③当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系
是_________________。
(3)反应Ⅲ,在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
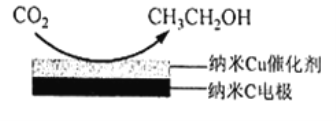
①阴极的电极反应式是____________________。
②从电解后溶液中分离出乙醇的操作方法是_________________。
③直接向KOH溶液中通入CO2,可以获得“经CO2饱和处理的KHCO3电解液”,该过程中浓度先增大后减小的离子是__________________ (填化学式)。
【答案】 CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) △H=+256 kJ·mol-1 < 化学平衡常数 进气比越大,反应温度越低 14CO2+12e-+9H2O→CH3CH2OH+12HCO3- 蒸馏 CO32-
【解析】试题分析:由反应Ⅰ和反应Ⅱ的平衡常数随温度的变化曲线可知,反应I是吸热反应、反应II是放热反应。
(1)反应Ⅰ中,1molCH3CH2OH(g)参与反应后的热量变化是256kJ,则反应1的热化学方程式是CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) △H=+256kJ·mol-1。
(2)①该反应为放热反应,温度升高后CO的平衡转化率减小,所以图中D、E两点对应的反应温度TD<TE。
②经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的化学平衡常数相同。
③反应II是一个反应前后气体分子数不变的放热反应。如果增大进气比[n(CO):n(H2O)],CO的转化率会降低,如果降低反应的温度,CO的转化率会增大。所以,当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是:进气比越大,反应温度越低。
(3)由题意可知,二氧化碳在阴极上被还原为乙醇。①阴极的电极反应式是14CO2+12e-+9H2O→CH3CH2OH+12HCO3-。②根据乙醇和水的沸点相差较大,从电解后溶液中分离出乙醇的操作方法可以选择蒸馏法。③直接向KOH溶液中通入CO2,可以获得“经CO2饱和处理的KHCO3电解液”,通入少量二氧化碳时,二氧化碳转化为碳酸根离子,若通入足量的二氧化碳,则碳酸根转化为碳酸氢根离子,所以,该过程中浓度先增大后减小的离子是CO32-。


科目:高中化学 来源: 题型:
【题目】物质的量是高中化学计算的核心:
(1)相同物质的量的NH3和H2S的质量比___,分子个数比为____,同温同压下的体积比___,所含氢原子的个数比为_____。
(2)现有mg某气体,它的一个分子由四原子构成,它的摩尔质量为Mg·mol-1。设阿伏加德罗常数为NA,则:①该气体的物质的量为____mol。②该气体中所含的原子总数为_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 甲烷是一种清洁能源,是天然气的主要成分
B. 用KMnO4溶液浸泡过的藻土可使水果保鲜,是利用了乙烯的氧化性
C. 苯不能使KMnO4酸性溶液褪色,说明它是一种饱和烃,很稳定
D. 己烷可以使溴水褪色,说明己烷中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(乙酰水杨酸,![]() )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:

制备基本操作流程如下:
![]()
主要试剂和产品的物理常数如下表所示:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 易水解 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是________________________________。
(2)合成阿司匹林时,最合适的加热方法是______________________。

(3)提纯粗产品流程如下,加热回流装置如图:
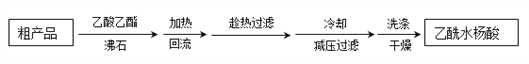
①沸石的作用是__________________________________;
②冷凝水的流出方向是________________(填“b”或“c”);
③使用温度计的目的是_____________________________________________________。
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(![]() ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为__________________(用百分数表示,小数点后一位)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为__________________(用百分数表示,小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,6-己二酸(G)是合成尼龙的主要原料之一,可用烃A氧化制备。制备G的合成路线如下:
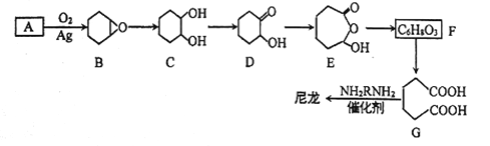
回答下列问题:
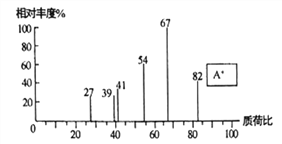
(1)化合物A的质谱图如下,则A的化学名称为_______________。
(2)C→D的反应类型为_____________。
(3)F的结构简式为_________________。
(4)写出能同时满足下列条件的X的同分异构体的结构简式______________。
①相对分子质量与F相等
②烃的含氧衍生物,能发生银镜反应
③核磁共振氢谱中有三组峰,面积比为3:2:1
(5)由G合成尼龙的化学方程式为____________________。
(6)由A通过两步反应制备1,3-环己二烯的合成路线为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1的HR溶液中逐渐滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电能力变化如图。下列分析不正确的是

A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7,此时酸碱恰好中和
C. b、c两点水的电离程度:b<c
D. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系正确的是( )
A. 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B. pH=8.3的NaHS溶液:c(Na+)>c(HS-)>c(S2-)>c(H2S)
C. pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D. 0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s) ![]() CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) ![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=![]()
B. 反应③的平衡常数K=![]()
C. 对于反应③,恒容时,温度升高,H2的浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2的浓度一定减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com