
【题目】高氯酸铵NH4ClO4是复合火箭推进剂的重要成分,实验室可通过下列反应制取
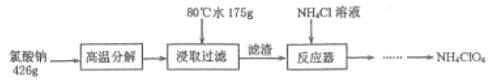
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为___________________________。
(2)反应得到的混合溶液中 NH4ClO4 和 NaCl 的质量分数分别为 0.30 和 0.15, 从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)_______、______、 _______、冰水洗涤、干燥。用冰水洗涤的目的是___________________________________________________。若氯化铵溶液用氨气和浓盐酸代替,则该反应不需要加热就能进行,其原因是_____________。
(3) 样品中NH4ClO4的含量可用蒸馏法进行则定,蒸馏装置如图所示(加热和仪器固定装置已略去),实验步骤如下:
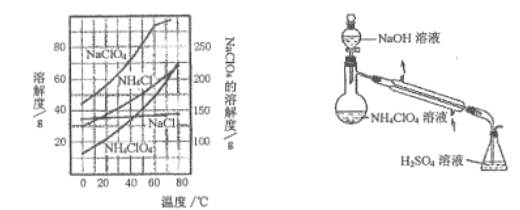
步骤1: 按上图所示组装仪器,检查装置气密性。
步骤2: 准确称取样品a g 于蒸馏烧瓶中,加入150mL 水溶解。
步骤3: 准确量取40.00mL、0.1000mol/L H2SO4溶解于锥形瓶中。
步骤4: 经分液漏斗向蒸馏瓶中加入20.00mL、3mol /LNaOH 溶液。
步骤5: 加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6: 用新煮沸过的水冲洗冷凝装置2--3 次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol/L NaOH 标准溶液滴定剩余H2SO4至终点时消耗NaOH 标准溶液VmL。
①步骤3 中,准确量取40.00mL.H2SO4溶液的玻璃仪器是___________。
②样品中NH4ClO4的质量分数为_______。若取消步骤6,则对定结果的影响是______(填“偏高”、“偏低”或“无影响”)。
【答案】 4NaClO3![]() NaCl 3NaClO4 蒸发浓缩 冷却结晶 过滤 减少洗涤过程中 NH4ClO4晶体的损失 氨气与浓盐酸反应放出热量 酸式滴定管
NaCl 3NaClO4 蒸发浓缩 冷却结晶 过滤 减少洗涤过程中 NH4ClO4晶体的损失 氨气与浓盐酸反应放出热量 酸式滴定管 ![]() 偏低
偏低
【解析】根据氧化还原反应原理和信息,氯酸钠受热分解生成高氯酸钠和氯化钠,可由图知,NaClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,80℃时浸取液冷却至0℃过滤,高氯酸钠的溶解度迅速降低,析出晶体,高氯酸钠中加入氯化铵饱和溶液,反应向着更难溶的物质转化,根据物质的溶解情况,可以知道会析出高氯酸铵,过滤洗涤干燥就可以得到高氯酸铵的固体。
(1)根据氧化还原反应原理和信息,氯酸钠受热分解生成高氯酸钠和氯化钠,得到方程式为4NaClO3![]() 3NaClO4+NaCl,故答案为:4NaClO3
3NaClO4+NaCl,故答案为:4NaClO3![]() 3NaClO4+NaCl;
3NaClO4+NaCl;
(2)由图可知,NH4ClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,NH4Cl、NaClO4的溶解度受温度影响也很大,但相同温度下,它们溶解度远大于NH4ClO4,故从混合溶液中获得较多NH4ClO4晶体的实验操作依次为:蒸发浓缩,冷却结晶,过滤,用冰水洗涤,可以减少洗涤过程中 NH4ClO4晶体的损失;氨气与浓盐酸反应放出热量,反应需要温度较低,故NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,故答案为:蒸发浓缩,冷却结晶;过滤;减少洗涤过程中 NH4ClO4晶体的损失;氨气与浓盐酸反应放出热量;
(3)①量取40.00mLH2SO4溶液的玻璃仪器为酸式滴定管,故答案为:酸式滴定管;
②NH4ClO4与氢氧化钠反应生成的氨气被硫酸吸收,剩余硫酸用氢氧化钠滴定,消耗的氢氧化钠的物质的量为cmol/L×V×10-3L=cV×10-3 mol,因此与氢氧化钠反应的硫酸为![]() mol,则NH4ClO4的物质的量为2×(0.0400L×0.1000mol/L-
mol,则NH4ClO4的物质的量为2×(0.0400L×0.1000mol/L-![]() mol)=2×(0.00400-
mol)=2×(0.00400-![]() )mol,因此样品中NH4ClO4的质量分数为
)mol,因此样品中NH4ClO4的质量分数为![]() ×100%=
×100%=![]() %,若取消步骤6,部分氨气未被硫酸吸收,导致V偏大,则
%,若取消步骤6,部分氨气未被硫酸吸收,导致V偏大,则![]() %偏低,故答案为:
%偏低,故答案为:![]() %;偏低。
%;偏低。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 甲烷是一种清洁能源,是天然气的主要成分
B. 用KMnO4溶液浸泡过的藻土可使水果保鲜,是利用了乙烯的氧化性
C. 苯不能使KMnO4酸性溶液褪色,说明它是一种饱和烃,很稳定
D. 己烷可以使溴水褪色,说明己烷中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系正确的是( )
A. 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B. pH=8.3的NaHS溶液:c(Na+)>c(HS-)>c(S2-)>c(H2S)
C. pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D. 0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲是人体细胞化合物含量的扇形图,图乙为人体内组成染色体的两种重要化合物A与C的化学组成关系,据图分析回答:

(1)若图甲表示细胞鲜重,则①化合物是_______,若图甲表示细胞干重,则①化合物是________,它在图乙中的物质是_______(用字母表示)。
(2)图乙中b分子通过______方式形成B,连接两个b分子的化学键叫做_______,若用结构式表示应为__________。
(3)在图乙中,a和b两种化合物其它的组成元素分别是_______、_______,化合物单体a的名称是________________。
(4)我们知道人的红细胞和心肌细胞的主要成分都是蛋白质,但这两种细胞的功能却完全不同,请你从蛋白质的结构方面做出解释_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯二氢硅(SiH2C12)常作于外延法工艺中重要的硅源。易燃、有毒,与水接触易水解,沸点8.2℃。在铜催化作用下,HCl 与硅在250-260℃反应可以制得SiH2Cl2.
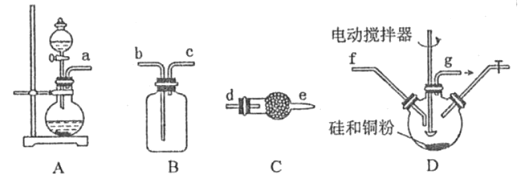
(1) 利用浓硫酸、浓盐酸为原料,选用A 装置制取HC1,利用了浓硫酸的_______性。
(2)D 装置中生成 二氯二氢硅的化学方程式为___________________。
(3) 按照气体从左到右方向,制取SiH2Cl2的装置连接次序为a→___→___→f→g→___→___→____→_____(填仪器接口的字母,其中装置C 用到2 次).其中装置B 的作用是____;前面装置C 中装的药品为______,后面装置C的作用为____________。
(4)新的制取SiH2Cl2 方法是: 往硅粉中先通入Cl2在300-350℃反应生成SiCl4,然后再与HCl 在250-260℃反应,可以大大提高产率。如果通入气体次序相反,产率会降低,其原因是__________(用化学方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s) ![]() CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) ![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=![]()
B. 反应③的平衡常数K=![]()
C. 对于反应③,恒容时,温度升高,H2的浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2的浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
如下图,A是单质,B为淡黄色固体。
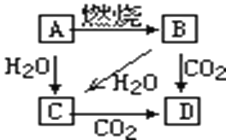
写出下列转化的化学方程式为:
(1)A→ B______________________________
(2)B→ D______________________________
(3)B→ C______________________________
(4)A→C_______________________________
(5)A与硫酸铜溶液反应_________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com