
【题目】(1)0.5molCH4的质量是_______________g,在标准状况下的体积为_______________L;含有约______________个氢原子。
(2)将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为_____
【答案】8 11.2 1.204×1024 5 mol·L-1
【解析】
(1)依据n=m/M、n=V/22.4及CH4的组成解答;
(2)依据c=n/v计算。
(1)0.5molCH4的质量为:m(CH4)=0.5mol![]() 16g/mol=8g, 在标准状况下的体积为:V=0.5mol
16g/mol=8g, 在标准状况下的体积为:V=0.5mol![]() 22.4L/mol=11.2L,所含的氢原子个数约为:0.5
22.4L/mol=11.2L,所含的氢原子个数约为:0.5![]() 4
4![]() =1.204×1024个;
=1.204×1024个;
本题答案为:8 , 11.2 ,1.204×1024。
(2)标准状况下22.4 L的HCl的物质的量为:n(HCl)=22.4L/22.4L/mol=1mol,将HCl溶于水,配成200 mL的溶液,所得溶液的物质的量浓度为:c(HCl)=1mol/0.2L=5mol/L;
本题答案为:5mol/L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据下表中实验操作、现象得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向饱和Na2CO3溶液中加入BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸 | 产生气泡 | Ksp(BaCO3)<Ksp(BaSO4) |
B | 向FeCl3溶液中滴加NaI溶液,然后滴加CCl4,振荡并静止 | 有机层出现紫 红色 | 氧化性:Fe3+>I2 |
C | 向Na2CO3溶液中滴加盐酸,将产生的气体通入硅酸钠溶液 | 溶液中出现白色沉淀 | 非金属性:Cl>C>Si |
D | 将碳与浓硫酸共热产生的气体通入酸性KMnO4溶液 | 溶液紫红色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:

甲:a(g)+b(g)![]() 2c(g) ΔH1<0、乙: x(g)+3y(g)
2c(g) ΔH1<0、乙: x(g)+3y(g)![]() 2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是
A. 在反应器恒温下,向乙中通入z气体,c的物质的量浓度增大
B. 在反应器恒温下,向甲中通入惰性气体,乙中x、y的转化率增大
C. 在反应器绝热下,向乙中通入z气体,反应器中温度升高
D. 在反应器绝热下,向甲中通入惰性气体,c的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
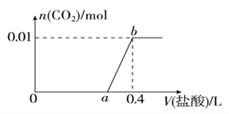
A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、钙的某些化合物在生产、生活中有着重要应用。请按要求回答下列问题。
Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)除去固体产物中Al2O3的离子方程式为_________________。
(2)常温,MgO可溶于NH4Cl溶液的化学方程式为_______________。
Ⅱ.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下:①在NH4Cl溶液中加入Ca(OH)2;②不断搅拌的同时加入30% H2O2溶液(弱酸性),生成CaO2·8H2O沉淀;③经过陈化、过滤、水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
(1)可循环使用的物质是______。工业生产中常选用过量的反应物是Ca(OH)2而不是H2O2,这是因为__________________。
(2) 检验CaO2·8H2O是否洗净的操作是________。
(3) 测定产品中CaO2含量:取m g样品,与足量稀硫酸反应充分,生成的H2O2用c mol·L-1的KMnO4溶液滴定,消耗标准液的体积为V mL,则该样品中CaO2质量百分数为(含m、c、V的表达式)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 某浓度的AlCl3溶液中滴入2 mol·L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:

(1)图中A点表示的意义是______________。
(2)最大沉淀量是______________g。
(3)B点表示的意义是______________。
(4)所用AlCl3溶液的物质的量浓度是______________。
(5)当所得沉淀量为0.39克时,用去NaOH溶液的体积是_____ mL 或_______ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。下列说法正确的是( )
2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。下列说法正确的是( )
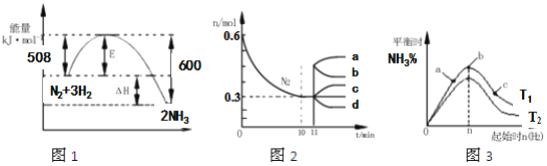
A. 由图1可知2NH3(g)![]() N2(g)+3H2(g)△H=﹣92kJmol﹣1
N2(g)+3H2(g)△H=﹣92kJmol﹣1
B. 图2中0~10min内该反应的平均速率v(H2)=0.045molL﹣1min﹣1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
C. 图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D. 图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为________ (阿伏加德罗常数用NA表示),放出的热量为________kJ。
(2)已知:C3H8(g) == CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6 kJ·mol-1
CH3CH=CH2(g) == CH4(g)+HC≡CH(g) ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g) === CH3CH=CH2(g)+H2(g)的ΔH=______kJ·mol-1。
(3)甲烷在高温下与水蒸气反应的方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。部分物质的燃烧热数据如下表:已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式: _______________________________。
CO(g)+3H2(g)。部分物质的燃烧热数据如下表:已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式: _______________________________。
物质 | 燃烧热(kJ·mol-1) |
H2(g) | -285.8 |
CO(g) | -283.0 |
CH4(g) | -890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从元素化合价和物质类别两个角度研究物质的性质,是一种行之有效的方法。以下是铁元素组成物质的二维图的部分信息。
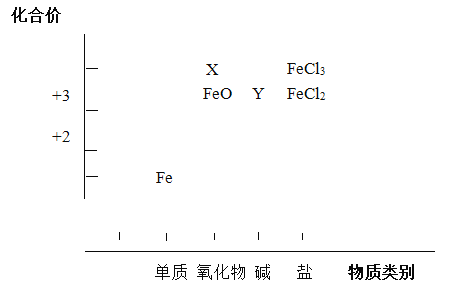
(1)分别写出X、Y的化学式______、______。
(2)写出FeO与稀硫酸反应的化学方程式____________。
(3)FeCl2既具有氧化性也具有还原性,分别写出体现其氧化性、还原性的反应的离子方程式。
| 离子方程式 |
氧化性 | ____________________ (一个即可) |
还原性 | ____________________ (一个即可) |
(4)某同学预测Fe3+可以与S2-发生反应,为验证预测,他结合资料信息,选择了两种试剂进行实验,确认了反应的发生。
资料:部分硫化物的溶解性表(室温)
阴离子 阳离子 | S2- |
Na+ | 溶 |
Fe3+ | 不 |
Fe2+ | 不 |
选取的试剂是______和______;可能发生的两种不同原理的反应的离子方程式是:_________、__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com