
【题目】镁、铝、钙的某些化合物在生产、生活中有着重要应用。请按要求回答下列问题。
Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)除去固体产物中Al2O3的离子方程式为_________________。
(2)常温,MgO可溶于NH4Cl溶液的化学方程式为_______________。
Ⅱ.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下:①在NH4Cl溶液中加入Ca(OH)2;②不断搅拌的同时加入30% H2O2溶液(弱酸性),生成CaO2·8H2O沉淀;③经过陈化、过滤、水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
(1)可循环使用的物质是______。工业生产中常选用过量的反应物是Ca(OH)2而不是H2O2,这是因为__________________。
(2) 检验CaO2·8H2O是否洗净的操作是________。
(3) 测定产品中CaO2含量:取m g样品,与足量稀硫酸反应充分,生成的H2O2用c mol·L-1的KMnO4溶液滴定,消耗标准液的体积为V mL,则该样品中CaO2质量百分数为(含m、c、V的表达式)__________。
【答案】Al2O3+2OH-![]() 2AlO2-+H2O2NH4Cl+H2O+MgO
2AlO2-+H2O2NH4Cl+H2O+MgO![]() MgCl2+2NH3·H2ONH4Cl过量Ca(OH)2使溶液显碱性,可以抑制CaO2·8H2O溶解,从而提高产品的产率;H2O2溶液呈弱酸性,会促进CaO2·8H2O溶解,降低产品产率。取适量最后一次洗涤液于试管中,加入稀硝酸,再向其中加入AgNO3溶液。18cV/m%
MgCl2+2NH3·H2ONH4Cl过量Ca(OH)2使溶液显碱性,可以抑制CaO2·8H2O溶解,从而提高产品的产率;H2O2溶液呈弱酸性,会促进CaO2·8H2O溶解,降低产品产率。取适量最后一次洗涤液于试管中,加入稀硝酸,再向其中加入AgNO3溶液。18cV/m%
【解析】
Ⅰ(1)固体产物中含有氧化镁和氧化铝,两者的区别在与氧化铝与强碱反应而氧化镁不能,加入氢氧化钠溶液溶解后过滤,离子反应方程式为:Al2O3+2OH-=2AlO2-+H2O;
(2)氯化铵溶液中铵根离子水解,溶液显酸性: NH4Cl+H2O![]() HCl+NH3·H2O,氧化镁与铵根离子水解产物反应:MgO+ 2HCl
HCl+NH3·H2O,氧化镁与铵根离子水解产物反应:MgO+ 2HCl ![]() MgCl2+ H2O,此反应促进铵根离子水解,所以总反应为:2NH4Cl+H2O+MgO
MgCl2+ H2O,此反应促进铵根离子水解,所以总反应为:2NH4Cl+H2O+MgO![]() MgCl2+2NH3·H2O;
MgCl2+2NH3·H2O;
Ⅱ(1)在NH4Cl溶液中加入Ca(OH)2,但是没有加热,因此反应方程式为:2NH4Cl +Ca(OH)2=2NH3·H2O+CaCl2;不断搅拌的同时加入30% H2O2溶液(弱酸性),生成CaO2·8H2O沉淀,反应方程式为CaCl2+ H2O2+6H2O+2NH3·H2O=CaO2·8H2ONH4Cl,所以可以循环使用的物质是NH4Cl;工业生产中常选用过量的反应物是Ca(OH)2而不是H2O2,这是因为过量Ca(OH)2能使溶液显碱性,可以抑制CaO2·8H2O溶解,从而提高产品的产率;
(2)检验最后一次洗涤液中是否含有氯离子,因此检验方法是:取适量最后一次洗涤液于试管中,加入稀硝酸,再向其中加入AgNO3溶液,观察是否有白色沉淀产生,如果没有,证明CaO2·8H2O已经洗涤干净;
(3)由CaO2+H2SO4=CaSO4+H2O2,5H2O2+2MnO4-+6H+=2Mn2++5O2![]() +8H2O可知:5CaO2
+8H2O可知:5CaO2![]() 2MnO4-,因此
2MnO4-,因此![]() ,所以该样品中CaO2的质量百分数
,所以该样品中CaO2的质量百分数![]() =18cV/m%。
=18cV/m%。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】树脂交联程度决定了树脂的成膜性。下面是一种成膜性良好的醇酸型树脂的合成路线,如下图所示。

(1)B的分子式为C4H7Br,且B不存在顺反异构,B的结构简式为________,A到B步骤的反应类型是_________。
(2)E中含氧官能团的名称是_________,D的系统命名为_________。
(3)下列说法正确的是_________。
A.1 mol化合物C最多消耗3 mol NaOH
B.1 mol化合物E与足量银氨溶液反应产生2 mol Ag
C.F不会与Cu(OH)2悬浊液反应
D.丁烷、1-丁醇、化合物D中沸点最高的是丁烷
(4)写出D、F在一定条件下生成醇酸型树脂的化学方程式_________。
(5)  的符合下列条件的同分异构体有_______种。
的符合下列条件的同分异构体有_______种。
①苯的二取代衍生物;②遇FeCl3溶液显紫色;③可发生消去反应
(6)①己知丙二酸二乙酯能发生以下反应:

②C2H5OH+HBr→C2H5Br+H2O
利用上述反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇钠为原料合成 ,请你设计出合理的反应流程图__________________。
,请你设计出合理的反应流程图__________________。
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有H2RO4=H++HRO4-、HRO4-![]() H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
A. ②和③等体积混合后的溶液中: c( Na+)= c( HRO4-)+c(H2RO4) +c(RO42-)
B. 100mL①溶液中: n(HRO4-)+n(RO42-)+n(OH-)-n(H+)= 0.01
C. ①和②等体积混合后的溶液中可能的离子浓度为c( HRO4-)>c(H+)>c(Na+)
D. 若①和③等体积混合后,会抑制水的电离,则HRO4-的电离程度肯定大于RO42-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是 ( )
A. 氢氧化亚铁在空气中的变化:2Fe(OH)2+O2+H2O=2Fe(OH)3
B. 硫酸亚铁溶液中加过氧化氢溶液:Fe2+ + 2H2O2 + 4H+=Fe3+ + 4H2O
C. 氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O
D. 硝酸铁溶液中加过量氨水:Fe3+ + 3NH3·H2O=Fe(OH)3 + 3NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5molCH4的质量是_______________g,在标准状况下的体积为_______________L;含有约______________个氢原子。
(2)将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的密闭容器中:NO(g) + CO(g)![]() 1/2N2(g) + CO2(g);△H = -373.2 kJ/mol,达到平衡后,为提高反应速率和NO的转化率,采取的正确措施是 ( )
1/2N2(g) + CO2(g);△H = -373.2 kJ/mol,达到平衡后,为提高反应速率和NO的转化率,采取的正确措施是 ( )
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯![]() 是一种天然抗癌药物。在一定条件下能发生如下转化。
是一种天然抗癌药物。在一定条件下能发生如下转化。
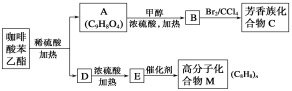
请回答下列问题:
(1)A分子中的官能团是_______________________________。
(2)高分子化合物M的结构简式是_______________________________。
(3)写出A→B反应的化学方程式:_________________________。A→B的反应类型为__________。
(4)E→M的反应方程式为_____________________;B→C的反应类型为__________。
(5)A的同分异构体有很多种,其中同时符合下列条件的同分异构体有________种。
①苯环上只有两个取代基 ②能发生银镜反应③能与碳酸氢钠溶液反应 ④能与氯化铁溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com