
����Ŀ�������ᱽ����![]() ��һ����Ȼ����ҩ���һ���������ܷ�������ת����
��һ����Ȼ����ҩ���һ���������ܷ�������ת����
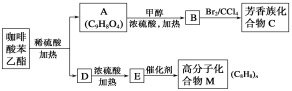
��ش��������⣺
��1��A�����еĹ�������_______________________________��
��2���߷��ӻ�����M�Ľṹ��ʽ��_______________________________��
��3��д��A��B��Ӧ�Ļ�ѧ����ʽ��_________________________��A��B�ķ�Ӧ����Ϊ__________��
��4��E��M�ķ�Ӧ����ʽΪ_____________________��B��C�ķ�Ӧ����Ϊ__________��
��5��A��ͬ���칹���кܶ��֣�����ͬʱ��������������ͬ���칹����________�֡�
�ٱ�����ֻ������ȡ���� ���ܷ���������Ӧ������̼��������Һ��Ӧ �������Ȼ�����Һ������ɫ��Ӧ
���𰸡��ǻ�(����ǻ�)���Ȼ���̼̼˫��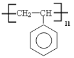
 ȡ����Ӧ�Ӿ۷�Ӧ�ӳɷ�Ӧ3
ȡ����Ӧ�Ӿ۷�Ӧ�ӳɷ�Ӧ3
��������
��ת����ϵ����֪���������ᱽ����ˮ������A��D��A�ķ���ʽΪC9H8O4����AΪ![]() ��DΪ
��DΪ![]() ��A��B����������Ӧ����BΪ
��A��B����������Ӧ����BΪ![]() ��B�к�̼̼˫������������Ȼ�̼��Һ�����ӳɷ�Ӧ����CΪ
��B�к�̼̼˫������������Ȼ�̼��Һ�����ӳɷ�Ӧ����CΪ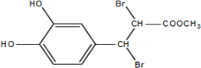 ��D��E������ȥ��Ӧ����EΪ
��D��E������ȥ��Ӧ����EΪ![]() ��E��M�����Ӿ۷�Ӧ����MΪ
��E��M�����Ӿ۷�Ӧ����MΪ![]() ��
��
��1����������������֪��AΪ![]() �������еĹ������ǣ��Ȼ���̼̼˫�����ǻ���
�������еĹ������ǣ��Ȼ���̼̼˫�����ǻ���
��2���߷��ӻ�����M�Ľṹ��ʽ��![]() ��
��
��3��A��B����������Ӧ��A��B��Ӧ�Ļ�ѧ����ʽ�� ��
��
��4��E�к�̼̼˫�������������·����Ӿ۷�Ӧ����M��B�к�̼̼˫������������Ȼ�̼��Һ�����ӳɷ�Ӧ����C��
��5��AΪ![]() ��A��ͬ���칹������������ٱ�����ֻ������ȡ���������ܷ���������Ӧ��˵����-CHO��������̼��������Һ��Ӧ��˵����-COOH���������Ȼ�����Һ������ɫ��Ӧ��˵�������ǻ������������Ľṹ��
��A��ͬ���칹������������ٱ�����ֻ������ȡ���������ܷ���������Ӧ��˵����-CHO��������̼��������Һ��Ӧ��˵����-COOH���������Ȼ�����Һ������ɫ��Ӧ��˵�������ǻ������������Ľṹ��![]() ��
��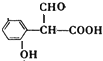 ��
��![]() ����3����
����3����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�������Ƶ�ijЩ��������������������������ҪӦ�á��밴Ҫ��ش��������⡣
��.������Mg5Al3(OH)19(H2O)4������������ȼ����,����ʱ�����·ֽⷴӦ:2Mg5Al3(OH)19(H2O)4![]() 27H2O��+10MgO+3Al2O3
27H2O��+10MgO+3Al2O3
(1)��ȥ���������Al2O3�����ӷ���ʽΪ_________________��
(2)���£�MgO������NH4Cl��Һ�Ļ�ѧ����ʽΪ_______________��
��.��������(CaO2)��һ�ְ�ɫ������������ˮ�Ĺ�������������ҵ������������:����NH4Cl��Һ�м���Ca(OH)2;�ڲ��Ͻ����ͬʱ����30% H2O2��Һ(������),����CaO2��8H2O����;�۾����»������ˡ�ˮϴ�õ�CaO2��8H2O,����ˮ����õ�CaO2��
(1)��ѭ��ʹ�õ�������______����ҵ�����г�ѡ�ù����ķ�Ӧ����Ca(OH)2������H2O2,������Ϊ__________________��
(2) ����CaO2��8H2O�Ƿ�ϴ���IJ�����________��
(3) �ⶨ��Ʒ��CaO2����:ȡm g��Ʒ,������ϡ���ᷴӦ���,���ɵ�H2O2��c mol��L-1��KMnO4��Һ�ζ�,���ı�Һ�����ΪV mL,�����Ʒ��CaO2�����ٷ���Ϊ(��m��c��V�ı���ʽ)__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ѹ���Ʊ������������������·�Ӧ�� KClO3+6HCl �� KCl + 3 Cl2�� +3 H2O�˷�Ӧ����Ҫ���ȣ������¾Ϳ���Ѹ�ٽ��У����Ҷ������Ũ��Ҫ�ߡ�
��1���á�˫���ŷ�����ʾ������ת�������KClO3+6HCl ��KCl + 3Cl2�� +3H2O______
��2���÷�Ӧ�У���������__________��
��3���ڱ�״���£�������4.48L Cl2����������ԭ����ĿΪ_______��(��NA��ʾ)
��4������0.5molHCl������ʱ���� ��_____________mol KClO3����ԭ��
��5��Ũ�����ڷ�Ӧ�б��ֳ�����������__________����д��ţ���
��ֻ�л�ԭ�� �ڻ�ԭ�Ժ����� ��ֻ�������� �������Ժ����ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ĵ���֦���̲طḻ�ķ����ѡ�����Դ������������(��Ҫ�ɷ�ΪTiO2��FeO��Fe2O3��Ti������ϼ�Ϊ��4)��ԭ�ϣ�������ɫ���϶������ѵ���Ҫ�������£�

��ش��������⣺
��1��������������ѷ�Ӧ�Ļ�ѧ����ʽ��______________________________________��
��2������Һ���м������ۣ�������Ӧ�����ӷ���ʽΪ____________��_______________��
��3����ʵ�����������У����ˮ�м�����Һ��ʹ���ҺpH��0.5�����ο�ʼˮ�⡣��дˮ������ӷ���ʽ��_________��
��4��ˮ������в���ͨ�����ˮ������ά����Һ����һ��ʱ�䣬���γ��ˮ������ˮ�϶������ѳ�����������ѧ��ѧƽ��ԭ������ͨ�����ˮ���������ã�_____________��
��5�����˷����ˮ�϶������ѳ�������Һ���ص���ҪĿ���dz��������Һ�е����Ρ�______(�ѧʽ)�����ٷ����ŷš�
��6��A������������ɫ����(Fe2O3)����ʵ�鷽���ǣ�
a��5.56a kg A(Ħ������Ϊ278g��mol-1)����ˮ�У�������������������Һǡ����ȫ��Ӧ�����������������裬�������ɫ���壻
b��������ɫ�����м���33.36b kg A��1.12c kg���ۣ����������������裬��Ӧ��ɺ��д���Fe2O3�����ڽ����������Գ�����ʽ������
c�����˺������������յú�ɫ���ϡ�
��������Һ������ֻ������غ����������������Ͽ�������ɫ����__________ kg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӏ�������ֵ������˵����ȷ����( )
A. 1molNa2O2�����к���������Ϊ4 NA
B. ������ΪNA��CO��C2H4����������ԼΪ22.4L������Ϊ28g
C. 28g��C2H4��C3H6��ɵĻ�����к�����ԭ�ӵ���ĿΪ4NA
D. �����£�1mol Fe�����ŨHNO3��Ӧ��ת�Ƶ��ӵ���ĿΪ3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�ػ��ϼۺ�������������Ƕ��о����ʵ����ʣ���һ����֮��Ч�ķ�������������Ԫ��������ʵĶ�άͼ�IJ�����Ϣ��
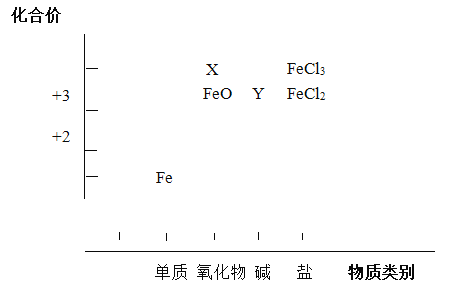
(1)�ֱ�д��X��Y�Ļ�ѧʽ______��______��
(2)д��FeO��ϡ���ᷴӦ�Ļ�ѧ����ʽ____________��
(3)FeCl2�Ⱦ���������Ҳ���л�ԭ�ԣ��ֱ�д�������������ԡ���ԭ�Եķ�Ӧ�����ӷ���ʽ��
| ���ӷ���ʽ |
������ | ____________________ (һ������) |
��ԭ�� | ____________________ (һ������) |
(4)ijͬѧԤ��Fe3+������S2-������Ӧ��Ϊ��֤Ԥ�⣬�����������Ϣ��ѡ���������Լ�����ʵ�飬ȷ���˷�Ӧ�ķ�����
���ϣ�����������ܽ��Ա�(����)
������ ������ | S2- |
Na+ | �� |
Fe3+ | �� |
Fe2+ | �� |
ѡȡ���Լ���______��______�����ܷ��������ֲ�ͬԭ���ķ�Ӧ�����ӷ���ʽ�ǣ�_________��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��A�Ļ�ѧʽΪC4H9Cl����֪A�ĺ˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣻��A�Ļ�ѧ����Ϊ________��
��2��ͬʱ�������������ı���ͬ���칹��Ľṹ��ʽ��________��
�ٺ���3��˫��
�ں˴Ź�������ֻ��ʾ1�����շ�
�۲����ڼ�
��3��д��ͬʱ��������������C6H10O4������ͬ���칹��Ľṹ��ʽ_________________��
��ֻ��һ�ֹ����ţ�����״�ṹ���ޡ�O��O�����ۺ˴Ź�������ֻ��2�ַ塣
��4��ij�������ǽṹʽΪ![]() ��ͬ���칹�壬�ҷ�����ֻ�����ֲ�ͬ��ѧ�������⡣д���û�����Ľṹ��ʽ��________(��дһ��)��
��ͬ���칹�壬�ҷ�����ֻ�����ֲ�ͬ��ѧ�������⡣д���û�����Ľṹ��ʽ��________(��дһ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������ܱ������м���2mol A��0.6mol C��һ������B�������塣һ�������·�����Ӧ��������Ũ����ʱ��仯�������ͼ����ʾ��ͼ��Ϊt2ʱ�̺�ı䷴Ӧ��������ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ��ζ����ı�һ�ֲ�ͬ����������֪t3��t4��Ϊʹ�ô�����ͼ����t0��t1��c��B��δ������
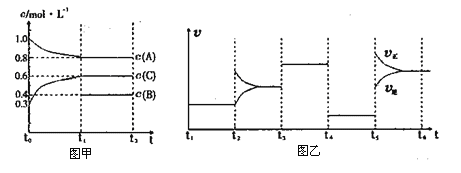
����˵������ȷ����
A. �÷�ӦΪ���ȷ�Ӧ
B. B��t0~t1�ε�ת����Ϊ60%
C. t4~t5�θı������Ϊ��Сѹǿ
D. ���¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.84
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��Ϊ̽�������Թ���X����ɺ����ʣ�����������ʵ�顣��֪X��һ�ֽ���������Ԫ�صľ��й̶��ɵ��������ʣ�H�ɵ�Ԫ�غ�����һ��Ԫ����ɣ�ͼ����������������ڱ�״���²ⶨ��
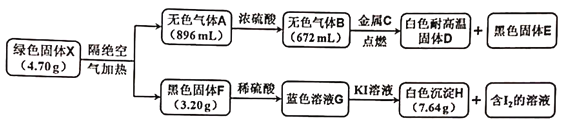
��ش��������⣺
��1��д��X�Ļ�ѧʽ__________��
��2��д��C��ԭ�ӽṹʾ��ͼ___________�����EԪ�ص�ij�ֺ��س����ڿ��Ŷϴ�����ԭ�Ӻ���������Ϊ8��д����У�ص�ԭ�ӷ���___________��
��3��C��װ��B�ļ���ƿ��ȼ�գ���ʵ������Ϊ___________����д����Ӧ�Ļ�ѧ����ʽ___________��
��4����֪H���뺬NaClO�ļ�����Һ��Ӧ����NaIO3����ɫ��״��������д���÷�Ӧ�����ӷ���ʽ____________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com