
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g)。在体积2L的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温 度的变化如图所示。下列说法正确的是( )
CH3OH(g)。在体积2L的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温 度的变化如图所示。下列说法正确的是( )
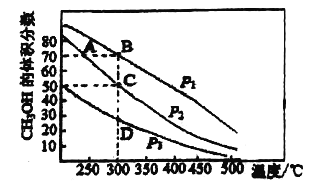
A. 该反应的△H<0,且p1<p2
B. 若p1时最初充入1molCO,经过5min达到B点的平衡状态,此段时间 v(CH3OH)=1.75mol/(L·min)
C. 在C点时,CO转化率为75%
D. A、B、C、D的平衡常数大小关系:A=B>C>D
【答案】C
【解析】
A.根据图像可知,升高温度CH3OH的体积分数下降,则该反应为放热反应,即ΔH<0;由方程式可知增大压强,平衡正向移动,CH3OH的体积分数增大,所以p1>p2,A错误;
B.若p1时最初充入1mol CO,经过5min达到B点的平衡状态,假设CO的转化量为x,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol) 1 2 0
变化(mol) x 2x x
平衡(mol) 1-x 2-2x x
在B点时,CH3OH的体积分数=![]() =70%,解得x=0.875mol,所以此段时间v(CH3OH)=
=70%,解得x=0.875mol,所以此段时间v(CH3OH)=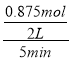 =0.0875mol/(L·min),B错误;
=0.0875mol/(L·min),B错误;
C.设向密闭容器充入了1mol CO和2mol H2,假设CO的转化量为y,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol) 1 2 0
变化(mol) y 2y y
平衡(mol) 1-y 2-2y y
![]() =0.5,解得y=0.75mol,所以CO的转化率为
=0.5,解得y=0.75mol,所以CO的转化率为![]() ×100%=75%,C正确;
×100%=75%,C正确;
D.由图可知,在其它条件不变时,升高温度,CH3OH的含量降低,说明升高温度,平衡逆向移动,逆反应方向为吸热反应,因此该反应的正反应是放热反应,因此温度越高,化学平衡常数越小,温度相同,则化学平衡常数相同,故A、B、C、D的平衡常数大小关系:A>B=C=D ,D错误;
故合理选项是C。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】用![]() 高能原子轰击
高能原子轰击![]() 的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
A. 112号元素的相对原子质量为277
B. 此变化不属于化学变化
C. 科学家合成的112号元素是金属元素
D. 112号元素位于第七周期第ⅡB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验报告中记录下列数据,其中正确的是
A. 用 100 mL 量筒量取 12.5 mL 盐酸
B. 称量 NaOH 固体时,将 NaOH 直接放在托盘上的纸上
C. 需用 220 mL, 1 mol·L-1 CuSO4 溶液,配制时需称 62.5g 的 CuSO4·5H2O 晶体
D. 配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.完成以下方程式:⑴写离子方程式,⑵⑶⑷写化学方程式
⑴Na与H2O:________________;
⑵氢氧化亚铁露置在空气中:________________;
⑶制粗Si:________________;
⑷少量CO2通入Na2SiO3溶液:________________。
II.有以下物质:①Fe2O3②Na2CO3③Cl2④浓盐酸⑤浓硫酸⑥SO2⑦高岭石Al2(Si2O5)(OH)4
⑸属于碱性氧化物的是________________(填序号);
⑹工业上用③与石灰乳制取漂白粉,漂白粉的有效成分的化学式是_____________;
⑺写出Cu与⑤反应的化学方程式________________。
⑻请将物质⑦改写成氧化物的形式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行的实验,能达到相应实验目的的是()
A. 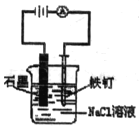 防止铁钉生锈
防止铁钉生锈
B.  除去乙烷中混有的乙烯
除去乙烷中混有的乙烯
C. 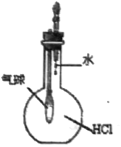 验证HCl气体在水中的溶解性
验证HCl气体在水中的溶解性
D. 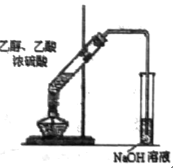 实验室制取乙酸乙酯
实验室制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1molN2中含有的分子数为2×6.02×1023B.电解饱和食盐水可得到金属钠
C.常温下,铝片能溶于浓硝酸D.常温下,淀粉溶液遇I2变成蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向盛有某盐溶液的试管中滴入氢氧化钠溶液后,加热,试管口处湿润的红色石蕊试纸变蓝 | 该盐中含 |
B | 向溴水中通入某无色气体,溴水褪色 | 该气体可能是CH2=CH2 |
C | 一定量的铜与硝酸充分反应后,有铜剩余,再加入少量稀硫酸,铜继续溶解,并有气泡放出 | Cu与稀硫酸发生了反应 |
D | 向淀粉溶液中加少量稀硫酸,加热4~5min。冷却后向其中加入新制Cu(OH)2悬浊液,加热至沸腾,无砖红色沉淀 | 淀粉没有发生水解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3 是合成其他含钴配合物的重要原料。在活性炭的催化作用下,通过氧化二氯化六氨合钴(II)得到三氯化六氨合钴(III)制备流程如下:
![]()
资料:
①钴离子常见价态有+2(II)价,+3(III)价,Co(II)离子能在水溶液中稳定存在,但 Co(III)离子不能稳定存在,只能以固态或络合物形式(如[Co(NH3)6]3+)稳定存在溶液中。
② Co2+在 pH=9.4 时完全沉淀为 Co(OH)2
(1) 实验中需要将 CoCl2·6H2O 晶体研细,其目的是:__________________。
(2)在加入浓氨水前先加入大量 NH4Cl溶液,请结合平衡原理解释原因______________________。
(3)在“氧化”过程中需水浴控温在 50~60℃,温度不能过高,原因是______________________。
(4)写出“氧化”过程中反应的离子方程式_______________。
(5)为测定产品中钴的含量,进行下列实验:
①称取样品 4.000 g 于烧瓶中,加水溶解,加入足量的 NaOH 溶液,加热至沸 15~20 min,将 [Co(NH3)6]Cl3 完全转化为 Co(OH)3,冷却后加入足量 KI 固体和 HCl 溶液,充分反应一段时间后,将烧瓶中的溶液全部转移至 250.00 mL 容量瓶中,加水定容,取其中 25.00 mL 试样加入到锥形瓶中;
②用 0.100 0 mol·L -1 Na2S2O3 标准溶液滴定,溶液变为浅黄色后,加入淀粉溶液作指示剂继续滴定至终点,重复 2 次实验,测得消耗 Na2S2O3 溶液的平均体积为 15.00 mL。(已知:2Co3++2I-=2Co2++I2 ,I2 +2S2O32-=2I-+S4O62-).通过计算确定该产品中钴的含量___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a 、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近均有气泡产生;铜珠n的右侧有气泡产生。 |
下列对实验现象的解释或推测不合理的是( )
A. 根据实验一的原理,实验二中铜珠m左侧变厚
B. a、d处:2H2O+2e-=H2↑+2OH-
C. b处:2Cl--2e-=Cl2↑;Cl2 + H2O =HCl + HClO
D. c处发生了反应:Fe-2e-=Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com