
| 放电 |
| 充电 |

| M(OH)x | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |


科目:高中化学 来源: 题型:
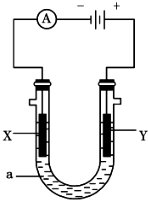 (1)电解池中与外电源负极相连的电极反应式为
(1)电解池中与外电源负极相连的电极反应式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在反应中NaClO3是还原剂,Na2SO3是氧化剂 |
| B、有反应可得ClO2的氧化性大于NaClO3的氧化性 |
| C、该反应中,H2SO4中各元素的化合价没有发生变化 |
| D、1mol NaClO3参加反应,则有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海产品用福尔马林(35%~40%的甲醛水溶液)浸泡进行防腐保鲜 |
| B、用SO2漂白食品以增强美观 |
| C、将含甲醇(CH3OH,对视神经有破坏作用)的工业酒精兑制成折酒 |
| D、自来水中通入少量Cl2进行消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光照 | B、温度 | C、压强 | D、催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何气体的体积一定是22.4L |
| B、在非标准状况下,1mol任何气体的体积不可能是22.4L |
| C、在标准状况下,体积为22.4L的物质都是1mol |
| D、标准状况下,22.4L的任何气体中都约含有6.02×1023个分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com