
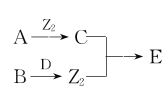
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种元素组成的化合物,Z2为Z元素的一种单质。已知:A、D均含有10个电子,C的相对分子质量为30。上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是
A.原子半径:W>Y>Z>X
B.若C中混有E可用水洗方法除去
C.A在工业上常用作制冷剂
D.B与D反应生成Z2时,D作还原剂
【答案】D
【解析】
X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种元素组成的化合物,Z2为Z元素的一种单质,已知A、D均含有10个电子,则A、D为氢化物,可能为CH4、NH3、H2O、HF等;根据转化关系可知,A与单质Z2反应生成C,B与D反应生成Z2,且C的相对分子质量为30,则C为NO,D为H2O,A为NH3,Z2为O2,B为Na2O2,E为NO2,结合原子序数大小可知,X为H,Y为N,Z为O,W为Na元素,据此解答。
根据分析可知,X为H,Y为N,Z为O,W为Na元素,A为NH3,B为Na2O2,C为NO,D为H2O,E为NO2。
A.同一周期元素,从左向右原子半径逐渐减小,当原子核外电子层数不同时,电子层越多原子半径越大,则原子半径:W>Y>Z>X,A正确;
B.NO2与水反应生成NO和硝酸,若NO中混有NO2,可用水洗方法除去,B正确;
C.A是NH3,氨气沸点较低易液化,液氨气化需吸收大量的热,从而使周围环境温度降低,因此液氨在工业上常用作制冷剂,C正确;
D.过氧化钠与水产生氢氧化钠和氧气,在该反应中,过氧化钠既作氧化剂又作还原剂,H2O在反应中元素化合价不变,既不是氧化剂也不是还原剂,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是

A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是_________________________________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________________________(填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
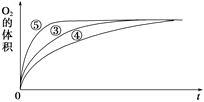
分析该图能够得出的实验结论是________________________________。
II.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如下图所示的实验装置进行实验。
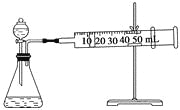
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量_______或______来比较。
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。请解释化学反应速率变化的原因:_____________。请计算H2O2的初始物质的量浓度为________________(保留两位有效数字)。
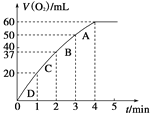
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无 需写出具体操作):/span>a._________________;b.___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2Ag+ + Cu = Cu2+ + 2Ag,设计如图所示原电池,下列说法错误的是( )。

A.X可以是银或石墨
B.Y是硫酸铜溶液
C.电子从铜电极经外电路流向X电极
D.X极上的电极反应式为Ag+ + e-= Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将0.3 mol CO2 和0.2 mol H2通入2 L密闭容器中,进行反应:CO(g)+ H2O(g) ![]() CO2(g)+ H2(g)。下列关于该反应建立平衡的说法正确的( )
CO2(g)+ H2(g)。下列关于该反应建立平衡的说法正确的( )
A.反应刚开始时,生成物浓度最大,正反应速率最小
B.随着反应的进行,反应物浓度逐渐减小,正反应速率逐渐增大
C.达到平衡状态时反应体系中CO2的浓度为0 mol˙L-1
D.该反应建立平衡过程中v―t(时间)图像如图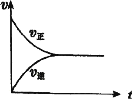
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质中选择合适的完成下列各题。
①稀硝酸;②CO;③HF;④熔融NaHSO4;⑤CaO;⑥Cu;⑦蔗糖;⑧Fe2(SO4) 3;⑨酒精;⑩硫酸钡;醋酸;三氧化硫;氯气;醋酸钠
(1) 属于强电解质的是____________________(填序号,下同) 。
(2) 属于弱电解质的是____________________。
(3) 属于非电解质的是_____________________。
(4) 写出③、两种物质在水溶液中的电离方程式:③___________________________;_________________________________。
(5) 醋酸钠溶液显_________性(填酸或碱)的原因:______________________________________________________________ (用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下的热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=—24.8kJ·mol-1
②Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) △H=—15.73kJ·mol-1
CO2(g) △H=—15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
A.-218kJ·mol-1B.-109kJ·mol-1C.+218kJ·mol-1D.+109kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学原理与应用有非常量要的意义。
(1)锌锰电池(俗称干电池)是一种一次电池,生活中应用广泛。若锌锰电池工作环境为酸性,则此时负极上的电极反应式为:___。
(2)铅蓄电池是最常见的二次电池:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
①放电时正极反应为(离子方程式):___。
②铅蓄电池放电时,当消耗了10.35gPb时,转移的电子的物质的量为___。
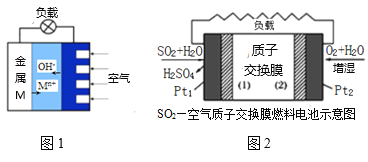
(3)如图1是金属(M)—空气电池的工作原理,我国首创的海洋电池以铅板为负极,铂网为正极,海水为电解质溶液,则该电池反应方程式为:___。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图2所示,则Pt2上的电极反应式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com