
【题目】根据反应:2Ag+ + Cu = Cu2+ + 2Ag,设计如图所示原电池,下列说法错误的是( )。

A.X可以是银或石墨
B.Y是硫酸铜溶液
C.电子从铜电极经外电路流向X电极
D.X极上的电极反应式为Ag+ + e-= Ag
科目:高中化学 来源: 题型:
【题目】白色固体PCl5受热即挥发并发生分解:PCl5(g)![]() PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,求平衡时PCl5的分解率__________。
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,求平衡时PCl5的分解率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在298 K条件下,2mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )。
A.2H2(g) + O2(g) = 2H2O(1) △H = - 484 kJ·mol-1
B.H2O(g) = H2(g) + ![]() O2(g) △H = + 242 kJ·mol-1
O2(g) △H = + 242 kJ·mol-1
C.H2(g) + ![]() O2(g) = H2O(g) △H = + 242 kJ·mol-1
O2(g) = H2O(g) △H = + 242 kJ·mol-1
D.2H2(g) + O2(g) = 2H2O(g) △H = + 484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常数表达式的正确的是( )。
A.NH3·H2O ![]() NH4+ + OH-Ka =
NH4+ + OH-Ka =
B.CH3CH2COO - + H2O![]() CH3CH2COOH +OH- Kh =
CH3CH2COOH +OH- Kh = 
C.AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp = c(Ag+)c(Cl-)
Ag+(aq)+Cl-(aq) Ksp = c(Ag+)c(Cl-)
D.FeO(s)+CO(g) ![]() Fe(s)+CO2(g) K =
Fe(s)+CO2(g) K =![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病。工业上利用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取As2O3的工艺流程如下:
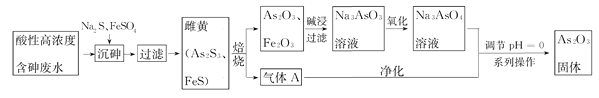
已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS32-
2AsS32-
回答下列问题:
(1)H3AsO3是一种两性偏酸性的化合物,As元素的化合价为_____________。
(2)“沉砷”中FeSO4的作用是________________________。
(3)“焙烧”过程产生的气体A的化学式为____________,检验该气体常用试剂为___________。
(4)调节pH=0时,发现酸性越强,As2O3的产率越高。可能的原因是__________________。获得As2O3固体,系列操作是________、______、_______。
(5)残留废渣中少量砒霜(As2O3)可以用双氧水氧化成H3AsO4而除去,该反应的化学方程式为:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种元素组成的化合物,Z2为Z元素的一种单质。已知:A、D均含有10个电子,C的相对分子质量为30。上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是
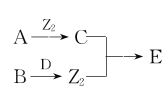
A.原子半径:W>Y>Z>X
B.若C中混有E可用水洗方法除去
C.A在工业上常用作制冷剂
D.B与D反应生成Z2时,D作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下在一容积恒为2L的容器内发生反应:2A(g)+B(g)![]() 2C(g),已知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变。下列说正确的是( )
2C(g),已知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变。下列说正确的是( )
A.2s内用物质A表示的平均反应速率为0.6mol/(L·s)
B.该条件下,该反应的平衡常数为K=![]()
C.2s后每有0.6mol的物质B生成,同时就有0.6mol物质C生成
D.2s时物质B的浓度为0.7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A和B反应的化学方程式为A(g)+2B(g)![]() C(g)。回答下列问题:
C(g)。回答下列问题:
(1)图1是反应A(g)+2B(g)![]() C(g)在不同温度下A的转化率随时间变化的曲线。
C(g)在不同温度下A的转化率随时间变化的曲线。
①该反应的H________(填“>”“<”或“=”)0。
②在T1温度下,向体积为1 L的密闭容器中,充入1 mol A(g)和2 mol B(g),测得A(g)和C(g)的浓度随时间变化如图2所示。则10 min内C的生成速率为________________。
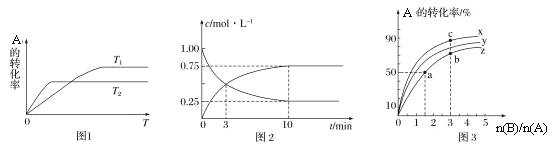
③若容器容积不变,下列措施可增加A转化率的是________(填字母)。
a.升高温度 b.将C(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容密闭容器中,分别研究在230°C、250°C和270°C条件下的上述反应。三种温度下B与A的物质的量之比与A平衡转化率的关系如图3所示。曲线z对应的温度是________°C。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com