
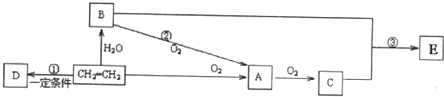
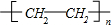 ,故答案为:
,故答案为: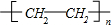 ;
;| Cu |
| △ |
| 浓硫酸 |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物稳定性:W<T |
| B、离子半径:X<R |
| C、最高价氧化物对应水化物碱性:X>Y |
| D、Y单质能与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 碳酸钠溶液 | 分液 |
| D | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
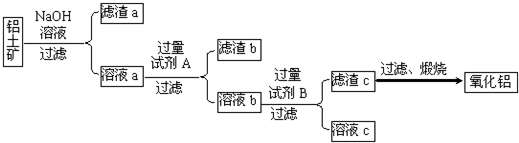
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| A | 雾 | 胶体 | 纯净物 |
| B | 金属氧化物 | 碱性氧化物 | 氧化物 |
| C | 碱 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 |
| B、电解池是将化学能转化为电能的装置 |
| C、任何酸溶液与碱溶液发生中和反应生成1mol水时放出的热量一定是相等的 |
| D、需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com