
 ,
, ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、H2、D2、T2互为同位素 |
| B、金属氧化物均为碱性氧化物 |
| C、质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒.其核外电子数为53 |
D、S2-的结构示意图: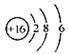 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 元素 | 结构或性质 | ||
| ① | A | 生活中最常见的金属,可被磁铁吸引 | ||
| ② | B | 原子最外层电子数是内层电子数的
| ||
| ③ | C | 形成化合物种类最多的元素之一,其单质为固体 | ||
| ④ | D | 地壳中含量最多的元素 | ||
| ⑤ | E | 与D同主族 | ||
| ⑥ | F | 与E同周期,且最外层电子数等于电子层数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将样品配制成溶液V1 L,取其中25.00mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2 mL |
| B、向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg |
| C、将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g |
| D、将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
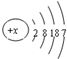 ,下列说法正确的是( )
,下列说法正确的是( )| A、R元素是第4周期Ⅶ族元素 |
| B、R元素的原子在反应中易失去电子 |
| C、R元素的最高价氧化物对应水化物为HRO4 |
| D、R元素的气态氢化物比同主族的上一周期元素的气态氢化物稳定性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别由Y、Z组成的单质一定都为原子晶体 |
| B、W与X形成的两种化合物中阴、阳离子的个数比均为1:2 |
| C、Y、Z、R最高价氧化物对应水化物的酸性强弱顺序:R>Z>Y |
| D、X的氢化物比R的氢化物稳定,X的氢化物熔沸点比R的氢化物高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
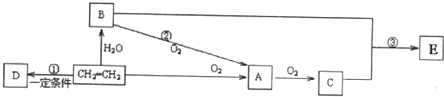
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度溶液,向容量瓶加水至离刻度线1~2cm时,改用胶头滴管定容 |
| B、可用湿润的pH试纸检验氨气 |
| C、用洁净的铂丝蘸取待测溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,该溶液中一定含有钾离子,不含有钠离子 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com