
【题目】某废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,某化学实验小组设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。

回答下列问题:
(1)写出向废液中加入过量铁粉发生反应的离子方程式______________________。
(2)沉淀A中含有的金属单质是_______________。
(3)下列物质中,可以用作试剂X的是_____________(填写序号)。
A.BaCl2 B.BaCO3 C.NaOH D.Ba(OH)2
(4)向溶液B中通入Cl2的作用是__________________;实验过程中该小组同学用NaCl固体、MnO2和浓硫酸混合加热的办法制得Cl2,写出反应的化学方程式________________;由于Cl2有毒,某同学建议用双氧水替换,请写出向溶液B中加入双氧水后发生反应的离子方程式__________________。
【答案】Fe+Cu2+=Fe2++Cu、Fe+2Fe3+=3Fe2+铁、铜BD将Fe2+ 氧化成Fe3+2NaCl+MnO2+3H2SO4(浓) ![]() 2NaHSO4+MnSO4+Cl2↑+2H2O2Fe2++2H++H2O2=2Fe3++2H2O
2NaHSO4+MnSO4+Cl2↑+2H2O2Fe2++2H++H2O2=2Fe3++2H2O
【解析】
加入的过量的铁屑,由于铁的化学性质比铜活泼,因此可以把金属铜从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在过滤得到的沉淀1中含有的金属单质铜过量的铁;滤液含有二价铁离子、钡离子、氯离子,通入Cl2将二价铁氧化成三价铁离子,再加碱调节pH值使三价铁离子转变成氢氧化铁沉淀而除去,所以沉淀2为氢氧化铁,进一步转化成氯化铁晶体,而滤液2则只剩氯化钡溶液,经过蒸发浓缩,冷却结晶、过滤、洗涤、干燥进一步转化成氯化钡固体。据此分析。
(1)向废液中加入过量铁粉发生的反应中属于置换反应的是铁把金属铜从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,反应的离子方程式为Fe+Cu2+=Fe2++Cu、Fe+2Fe3+=3Fe2+,
故答案为:Fe+Cu2+=Fe2++Cu、Fe+2Fe3+=3Fe2+;
(2)废液中含有Fe3+、Cu2+两种金属离子,加入过量的铁粉后,铜离子被还原成金属铜,所以在第①得到的沉淀中含有金属铜和过量的铁,
故答案为:铜、铁;
(3)根据以上分析,加试剂X调节pH值使三价铁离子转变成氢氧化铁沉淀而不能引入新的杂质,所以选BD,
故答案为:BD;
(4)向溶液B中通入Cl2可以将Fe2+ 氧化成Fe3+;NaCl固体与浓硫酸混合加热生成氯化氢、氯化氢与MnO2加热反应生成Cl2,反应的化学方程式为NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑,MnO2+4HCl
Na2SO4+2HCl↑,MnO2+4HCl![]() MnCl2+Cl2↑+2H2O或2NaCl+MnO2+3H2SO4(浓)
MnCl2+Cl2↑+2H2O或2NaCl+MnO2+3H2SO4(浓) ![]() 2NaHSO4+MnSO4+Cl2↑+2H2O;向溶液B中加入双氧水后发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,
2NaHSO4+MnSO4+Cl2↑+2H2O;向溶液B中加入双氧水后发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:将Fe2+ 氧化成Fe3+;2NaCl+MnO2+3H2SO4(浓) ![]() 2NaHSO4+MnSO4+Cl2↑+2H2O;2Fe2++2H++H2O2=2Fe3++2H2O。
2NaHSO4+MnSO4+Cl2↑+2H2O;2Fe2++2H++H2O2=2Fe3++2H2O。


科目:高中化学 来源: 题型:
【题目】某天然碱组成可表示为xNa2CO3·yNaHCO3·zH2O。取m g该天然碱配成1L溶液M。取出100mLM向其中加入50mL1 mol·L-1盐酸,两者恰好完全反应生成NaCl,同时产生CO2的体积为672mL(标准状况下),下列推断正确的是( )
A. m g该天然碱中含0.3molNa2CO3 B. m g该天然碱中含0.3molNa+
C. 溶液M中c(Na+)=0.5 mol·L-1 D. 该天然碱中x:y:z=2:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将BaSO4放入水中不能导电,所以硫酸钡不是电解质
B.NaCl溶液能导电,所以NaCl溶液是电解质
C.NH3溶于水能导电,所以NH3是电解质
D.固态的NaCl不导电,熔融态NaCl可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“二![]() 英”是二苯基1,4二氧六环及其衍生物的通称,其中一种毒性最大的结构是
英”是二苯基1,4二氧六环及其衍生物的通称,其中一种毒性最大的结构是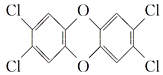 ,关于这种物质的叙述中不正确的是( )
,关于这种物质的叙述中不正确的是( )
A. 该物质不属于芳香族化合物
B. 该物质是一种卤代烃
C. 1 mol该物质最多可与6 mol H2在一定的条件下发生反应
D. 该物质分子中所有原子可能处在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A. 混合气体的压强B. 混合气体密度
C. A的物质的量浓度保持不变D. 气体总物质的量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
半导体材料磷化硼(BP)可由BBr3和PBr3在高温下合成。回答下列问题:
(1)基态P原子的价电子排布式为__________,同周期中第一电离能比P 小的元素有______种。
(2)在水中的溶解度BBr3_______PBr3(填“ >”或“ <”),原因是_____________。
(3)一定温度下PBr5能形成阴、阳离子个数比为1:1的导电熔体,经测定其中P—Br键键长均相等。写出该导电熔体中阳离子的电子式:_________,其中P原子的杂化轨道类型是_______。
(4)已知磷化硼晶体中P原子作A1型最密堆积,B原子填入四面体空隙中,相邻P原子和B原子核间距为d cm,则该晶体中每个B原子周围有_____个B原子与它距离最近,晶体密度为____g·cm-3(NA表示阿伏加德罗常数的值),若某个P原子的坐标为(0,0,0),则晶胞中其余P原子的坐标为__________(写出一个即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
以芳香烃A为原料发生如下图所示的变化,可以合成两种高聚物G和H。已知:两个羟基连在同一碳原子上不稳定,会自动脱水。

回答下列问题:
(1)A 中官能团的名称是_____________;C的结构简式为_____________。
(2)B→C的反应条件是____________,D→E的反应类型是_______________。
(3)写出E→G 的化学方程式:_____________________。
(4)E的同分异构体中,苯环上有4 个取代基、遇FeCl3溶液显紫色且能与碳酸氢纳溶液反应生成 CO2的共 有__________种(不考虑立体异构),其中核磁共振氢谱显示有4 种不同化学环境的氢的结构简式为_____________(写出一种即可)。
(5)参照上述合成路线,以丙炔为原料(无机试制任选),设计可降解塑料聚乳酸(PLA)的合成路线________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com