
| A. | NH4+、H+、NO3-、HCO3- | B. | K+、Na+、HCO3-、OH- | ||
| C. | Na+、Ba2+、SO32-、Cl- | D. | Na+、CH3COO-、CO32-、OH- |
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | b>a | C. | a=b | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

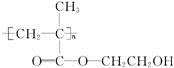 .
.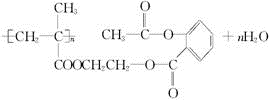
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳、氮原子构成网状的原子晶体 | |
| B. | 膜中的C-N键长比金刚石的C-C键长短 | |
| C. | 碳、氮都是非金属,化合时放出大量热 | |
| D. | 相邻主族非金属的化合物比单质硬度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
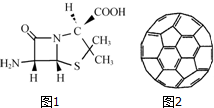 在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.
在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X的某种单质是一种新型自来水消毒剂 | |
| B. | 简单离子半径:W->R2->X2->S3+ | |
| C. | R、Z不可能形成离子化合物 | |
| D. | 字母所代表的元素中最高价氧化物的水化物酸性最强的是Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+). |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com