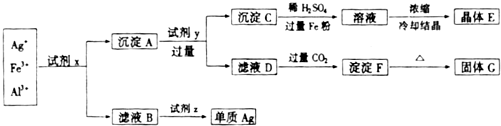
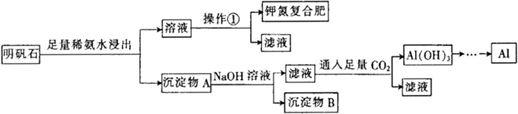
分析:明矾石含有Al
2O
3和少量的Fe
2O
3等杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀A中含Al
2O
3、Fe
2O
3、Al(OH)
3,溶液中含钾离子、硫酸根离子,操作①为蒸发结晶得到硫酸钾、硫酸铵晶体,Al
2O
3、Fe
2O
3、Al(OH)
3中加入氢氧化钠,Al
2O
3、Fe
2O
3与氢氧化钠不反应,氢氧化铝与氢氧化钠反应Al(OH)
3+NaOH═NaAlO
2+2H
2O,沉淀B为Al
2O
3、Fe
2O
3,滤液为NaAlO
2溶液,通入足量的二氧化碳,NaAlO
2+CO
2+2H
2O=Al(OH)
3↓+NaHCO
3;氢氧化铝加热得到氧化铝,氧化铝电解得到铝.
(1)明矾石加入足量的稀氨水中浸出时铝离子会和氨水之间反应生成氢氧化铝;
(2)Al
2O
3和Fe
2O
3、Al(OH)
3都和氨水之间不反应;
(3)溶液蒸发浓缩、冷却结晶、过滤可以得到其晶体物质;
(4)①配制480mL溶液,应选择500mL容量瓶;②根据洗涤仪器的方法来进行;③根据c=
来确定引起的误差;
(5)确定钾氮复合肥中含有钾元素的方法是焰色反应;
(6)根据元素守恒来计算,钾氮复合肥中氮元索的物质的量等于氨气的物质的量;
解答:
解:明矾石含有Al
2O
3和少量的Fe
2O
3等杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀A中含Al
2O
3、Fe
2O
3、Al(OH)
3,溶液中含钾离子、硫酸根离子,操作①为蒸发结晶得到硫酸钾、硫酸铵晶体,Al
2O
3、Fe
2O
3,Al
2O
3、Fe
2O
3、Al(OH)
3中加入氢氧化钠,Al
2O
3、Fe
2O
3与氢氧化钠不反应,氢氧化铝与氢氧化钠反应Al(OH)
3+NaOH═NaAlO
2+2H
2O,沉淀B为Al
2O
3、Fe
2O
3,滤液为NaAlO
2溶液,通入足量的二氧化碳,NaAlO
2+CO
2+2H
2O=Al(OH)
3↓+NaHCO
3;氢氧化铝加热得到氧化铝,氧化铝电解得到铝.
(1)明矾石加入足量的稀氨水中浸出时发生反应的离子方程式为Al
3++3NH
3.H
2O=Al(OH)
3↓+3NH
4+,
故答案为:Al
3++3NH
3?H
2O=Al(OH)
3↓+3NH
4+;
(2)杂质均不溶于氨水,铝离子与氨水反应生成沉淀,沉淀A中含Al
2O
3、Fe
2O
3、Al(OH)
3,
故答案为:Al
2O
3;Al(OH)
3;
(3)由上述分析可知,操作1为蒸发浓缩结晶得到硫酸钾晶体,
故答案为:蒸发浓缩;
(4)①配制480mL溶液,应选择500mL容量瓶,
故答案为:500mL容量瓶;
②稀释浓氨水用的烧杯和玻璃棒的洗涤方法:适量的蒸馏水沿着玻璃棒注入烧杯中,倾斜转动烧杯,洗涤烧杯内壁后将洗涤液转入容量瓶中,重复操作2~3次,
故答案为:取适量蒸馏水沿玻璃棒注入烧杯中,倾斜转动烧杯,洗涤烧杯内壁后将洗涤液转入容量瓶中,重复操作2~3次;
③a、定容时需加水,洗涤后的容量瓶中有少量蒸馏水,不会影响实验结果,
故答案为:无影响;
b、用量筒量取浓氨水后,用蒸馏水洗涤量筒并转移至容量瓶中,溶质增多,浓度偏大,
故答案为:偏大;
(5)确定钾氮复合肥中含有钾元素的方法是焰色反应,透过蓝色钴玻璃观察到紫色火焰,则含钾元素,
故答案为:焰色反应;
(6)足量的NaOH浓溶液加热,使产生的气体全部逸出,收集到的氨气折箅成标准状况下的体积为VmL,根据N元素守恒,则钾氮复合肥中氮元索的物质的量为
mol,所以钾氮复合肥中氮元索的质量分数为
×100%=
%,
故答案为:
%.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案