
| 实例 | 影响速率的因素 | 如何影响 |
| 粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快 | 反应物颗粒的大小(或 反应物接触面积的大小) | 反应物的颗粒越小(或 反应物接触面积越大),反应速率越快 |
| 夏天食物易变质 | ||
| 硫在氧气中比在空气中燃烧快 | ||
| 双氧水与二氧化锰混合可快速产生氧气 | ||
| 工业合成氨通常要在高压下进行 |
| 实例 | 影响速率的因素 | 如何影响 |
| 粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快 | 反应物颗粒的大小(或 反应物接触面积的大小) | 反应物的颗粒越小(或 反应物接触面积越大),反应速率越快 |
| 夏天食物易变质 | 温度 | 温度升高,反应速率加快 |
| 硫在氧气中比在空气中燃烧快 | 反应物浓度 | 反应物浓度增大,反应速率加快 |
| 双氧水与二氧化锰混合可快速产生氧气 | 催化剂 | 加入催化剂,增大反应速率 |
| 工业合成氨通常要在高压下进行 | 压强 | 压强增大,反应速率加快 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体 |
| B、氧化铝的熔点很高,可用于制造熔融烧碱的坩埚 |
| C、炭具有还原性,高温下能将二氧化硅还原为硅 |
| D、饱和氯水既有酸性又有漂白性,加入NaHCO3漂白性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸的体积增大 |
| B、用小刀切割金属钠时,发现切面由银白色变暗 |
| C、澄清的石灰水变浑浊 |
| D、氢氧化钠的表面发生潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、点燃酒精灯,灯芯燃烧产生黄色火焰 |
| B、碳与氧化铜共热,黑色固体变成红色 |
| C、往澄清石灰水中吹气,石灰水变混浊 |
| D、稀硫酸中加入锌粒,有无色气泡从溶液中逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:SiI4<SiBr4<SiCl4<SiF4 |
| B、沸点:H2S>H2O>HF>NH3 |
| C、熔点:金刚石>晶体硅>晶体锗>硫 |
| D、硬度:金刚石>白磷>冰>水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
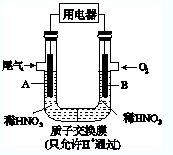 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )| A、电极A表面反应之一为NO2-e-+H2O═NO3-+2H+ |
| B、电极B附近的c(NO3-)增大 |
| C、电解质溶液中电流的方向由B到A,电子的流向与之相反 |
| D、该电池工作时,每转移4 mol电子,生成22.4LO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 标准状况,体积相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解.
标准状况,体积相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com