

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
| Ksp |
| c(Mn2+) |
| 1.0×10-11 |
| 1.0×10-5 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、3个 | B、4个 | C、5个 | D、6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
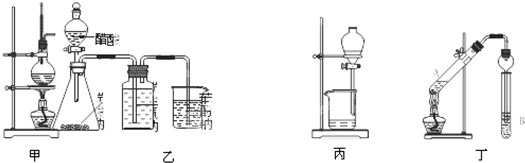
| A、甲装置:加热浓硫酸和乙醇(其体积为比3:1)混合液,制取乙烯 |
| B、乙装置:比较醋酸、碳酸、苯酚三者的酸性强弱 |
| C、丙装置:向混有苯酚的苯中加入NaOH溶液,除去其中的苯酚 |
| D、丁装置:A中为乙醇、醋酸,B为饱和碳酸钠溶液,制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不可通过核磁共振氢谱鉴别苯酚和环己醇 |
| B、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| C、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| D、米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④⑥ | B、②③⑤ |
| C、①④⑤ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ Fe3+ Cl- I- |
| B、Ca2+、K+、Cl-、HCO3- |
| C、Mg2+ Na+ SO42-Cl- |
| D、K+ Na+ SO42-NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
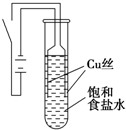 某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水.
某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水.| 物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
| 颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
| A、反应结束后最终溶液呈碱性 |
| B、阴极上发生的电极反应为:2H2O+2e?═H2↑+2OH? |
| C、电解过程中氯离子移向阳极 |
| D、试管底部红色的固体具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实例 | 影响速率的因素 | 如何影响 |
| 粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快 | 反应物颗粒的大小(或 反应物接触面积的大小) | 反应物的颗粒越小(或 反应物接触面积越大),反应速率越快 |
| 夏天食物易变质 | ||
| 硫在氧气中比在空气中燃烧快 | ||
| 双氧水与二氧化锰混合可快速产生氧气 | ||
| 工业合成氨通常要在高压下进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com